求人検索
- 1
- 2
- 3
- 4
- 5
■Clinical Research Associate (FSO)
- 採用企業名
- 非公開
- 職種
-
メディカル・バイオ - 臨床開発モニター
- 雇用形態
- 無期雇用
- 勤務地
-
大阪府
- 仕事内容
-
...
・治験に係る文書等の点検および管理
・モニタリング報告書の点検および管理
・治験データ、症例報告書の点検および管理
・治験薬業務に係る業務の点検
・管理表の作成、入力、点検
・画像解析業務に関連する手順書の点検 など
※外勤は平均3-4回。内、宿泊を伴う出張は月1-2回 (担当施設の数と場所、症例数に応じて変動あり)■休日:完全週休二日制, 土, 日, 祝日, 年末年始
- 求める経験
-
...
・学士資格(薬学、医学、生物科学、看護などの分野尚可)
・臨床開発モニターとしての3年以上の経験(医薬品、医療機器)
・GCP(Good Clinical Practice) の知識
・英語を使用することに抵抗感の無い方■職種未経験者:不可
- 想定年収
- 500万円 - 800万円
- 語学力
-
英語力:初級以上・英語力は読み書き程度(学習意欲を評価します。)
英語学習補助(①自己学習費用 上限1万円/月②TOEIC受験料全額支給 上限1回/年③英語学習サポートチームの設置)
臨床開発職
■CRA<FSP>
- 採用企業名
- 非公開
- 職種
-
メディカル・バイオ - 臨床開発モニター
メディカル・バイオ - 臨床開発リーダー・臨床開発プロジェクトマネージャー
- 雇用形態
- 無期雇用
- 勤務地
-
大阪府
- 仕事内容
-
...
Job Description
Responsible for all aspects of study site monitoring including routine monitoring and close-out of clinical sites, maintenance of study files, conduct of pre-study and initiation visits; liaise with venders; and other duties, as assigned
- Assures the implementation of project plans for the clients as assigned at the client office, where you will be dispatched
- Responsible for all aspects of site management as prescribed in the project plans
General on-Site Monitoring Responsibilities:
- Ensure the study staff who will conduct the protocol have received the proper materials and instructions to safely enter patients into the study
- Ensure the protection of study patients by verifying that informed consent procedures and protocol requirements are adhered to according to the applicable regulatory requirements
- Ensure the integrity of the data submitted on Case Report Forms (CRFs ) or other data collection tools by careful source document review. Monitor data for missing or implausible data
- Ensure the resources of the Sponsor and Fortrea are spent wisely by performing the required monitoring tasks in an efficient manner, according to SOPs and established guidelines, including managing travel expenses in an economical fashion according to Fortrea travel policy
- Prepare accurate and timely trip reports
- Manage small projects under direction of a Project Manager/Director as assigned
- Serve as lend monitor for a protocol or project, and may assist in establishing monitoring plans and trip report review as assigned
- Review progress of projects and initiate appropriate actions to achieve target objectives
- Organize and make presentations at Investigator Meetings
- Participate in the development of protocols and Case Report Forms as assigned
- Participate in writing clinical trial reports as assigned
- Interact with internal work groups to evaluate needs, resources and timelines
- Act as contact for clinical trial supplies and other supplies (vendors) as assigned
- Responsible for all aspects of registry management as prescribed in the project plans
- Undertake feasibility work when requested
- Conduct, report and follow-up on Quality Control Visit (CQC) when requested
- Recruitment of potential investigators, preparation of EC submissions, notifications to regulatory authorities, translation of study-related documentation, organization of meetings and other tasks as instructed by supervisor as assigned
- Negotiate study budget with potential investigators and assist the Fortrea legal department with statements of agreements as assigned
- Complete process of Serious Adverse Event (SAE) reporting, process production of reports, narratives and follow up SAEs
- Independently perform CRF review; query generation and resolution against established data review guidelines on Fortrea or clinical data management system assigned by management
- Assist with training, mentoring and development of new employees, e.g. co-monitoring
- Co-ordinate designated clinical projects as a Local Project Coordinator (with supervision, if applicable), and may act as a local client contacts as assigned
- Perform other duties as assigned by management
- To be dispatched to the client for the project following the clients’ working conditions (working hours/working places)■休日:完全週休二日制, 土, 日, 祝日, 年末年始
- 求める経験
-
...
・学士資格(薬学、医学、生物科学、看護などの分野尚可)
・臨床開発モニターとしての3年以上の経験(医薬品、医療機器)
・GCP(Good Clinical Practice) の知識
・英語を使用することに抵抗感の無い方■職種未経験者:不可
- 想定年収
- 500万円 - 800万円
- 語学力
-
英語力:中級以上
ベトナム事業の推進業務【ロート製薬グループ】
- 採用企業名
- ロートニッテン株式会社
- 職種
-
営業 - 法人営業(その他)
営業 - 海外営業
営業 - OTC営業
営業 - 医療機器営業
営業 - 診断薬営業・ライフサイエンス営業
営業 - 法人営業(消費財)
営業アシスタント・カスタマーサービス - 秘書
営業アシスタント・カスタマーサービス - 秘書(外国人付)
営業アシスタント・カスタマーサービス - 営業アシスタント
営業アシスタント・カスタマーサービス - 一般事務・アシスタント
営業アシスタント・カスタマーサービス - 通訳・翻訳
営業アシスタント・カスタマーサービス - 病院事務・医療事務
技術系(機械設計・製造技術) - 化学(研究・開発・分析)
技術系(機械設計・製造技術) - 食品(研究・開発・分析)
技術系(機械設計・製造技術) - 化粧品(研究・開発・分析)
メディカル・バイオ - 創薬・テクニシャン
メディカル・バイオ - 前臨床(薬効薬理・毒性・ADME)
メディカル・バイオ - 臨床開発モニター
メディカル・バイオ - 医療機器モニター
メディカル・バイオ - 臨床開発QC・GCP監査
メディカル・バイオ - 臨床開発リーダー・臨床開発プロジェクトマネージャー
メディカル・バイオ - 臨床開発メディカルライター
メディカル・バイオ - 医薬品ライセンシング
メディカル・バイオ - メディカルデータマネジメント
メディカル・バイオ - 統計解析
メディカル・バイオ - 薬事申請
メディカル・バイオ - メディカル教育
メディカル・バイオ - 安全性情報(臨床開発・製販後GVP)
メディカル・バイオ - 製造販売後調査(GPMSP)
メディカル・バイオ - メディカルGQP・GMP・品質保証・品質管理
メディカル・バイオ - 流通対策
メディカル・バイオ - CRC・治験コーディネーター
メディカル・バイオ - 管理薬剤師
メディカル・バイオ - テクニカルサポート・アプリケーションスペシャリスト
メディカル・バイオ - クリニカルスペシャリスト
メディカル・バイオ - メディカルサイエンスリエゾン
メディカル・バイオ - 品質保証
メディカル・バイオ - 品質管理
メディカル・バイオ - メディカルアフェアーズ
メディカル・バイオ - CMC薬事
医療・介護・福祉 - 医師
医療・介護・福祉 - 薬剤師
医療・介護・福祉 - 看護師
医療・介護・福祉 - 臨床検査技師
医療・介護・福祉 - 臨床工学技士
医療・介護・福祉 - 管理栄養士
医療・介護・福祉 - 獣医師
医療・介護・福祉 - 介護・福祉関連職
医療・介護・福祉 - 放射線技師
医療・介護・福祉 - 保健師
- 雇用形態
- 無期雇用
- 勤務地
-
愛知県 東京都
- 仕事内容
-
...
同社の東京オフィスあるいは名古屋本社にて、ベトナム関連のプロジェクトに携わっていただきます。
【具体的には】
・ベトナム拠点への医薬品技術の移管
・現地で製造している製品の日本側窓口対応の強化
・社長や役員との現地取引先への同行
・営業事務やベトナム語での通訳業務
名古屋や東京、両拠点への出張やベトナムへの出張も想定しています。■休日:完全週休二日制, 土, 日, 祝日, GW
- 求める経験
-
...
【必須条件】
ベトナム語ビジネスレベル■職種未経験者:不可
- 想定年収
- 450万円 - 550万円
- 語学力
-
英語力:初級以上
臨床企画業務
- 採用企業名
- 千寿製薬株式会社
- 職種
-
メディカル・バイオ - 臨床開発モニター
メディカル・バイオ - 臨床開発リーダー・臨床開発プロジェクトマネージャー
- 雇用形態
- 無期雇用
- 勤務地
-
兵庫県
- 仕事内容
-
...
・医薬品の臨床試験パッケージの立案
・臨床試験デザインの立案
・導入候補化合物の評価■休日:完全週休二日制
- 求める経験
-
...
<必須要件>
・製薬企業、CROにおいて、医薬品の臨床開発を5年以上経験されている方
・理系の大学院、または6年制薬学部を卒業されている方
・英語への抵抗がない方
<望ましい要件>
・製薬企業において臨床企画業務を経験されている方
・ビジネス英会話ができる方
・眼科疾患領域の知識を有している方
・医学科学分野の公表論文を自ら作成した経験がある方
・統計解析の知識がある方
・ICHを理解している方
<求める人物像>
・チームワークとリーダーシップを発揮できる方
・柔軟性が高く変化に対応できる方
・やり抜く強い意志を持ち、困難な状況でも粘り強く取り組める方■職種未経験者:不可
- 想定年収
- 500万円 - 770万円
- 語学力
-
英語力:初級以上
モニター職
- 採用企業名
- 千寿製薬株式会社
- 職種
-
メディカル・バイオ - 臨床開発モニター
- 雇用形態
- 無期雇用
- 勤務地
-
兵庫県
- 仕事内容
-
...
モニタリング業務
担当地区は全国(海外を担当する可能性もある)
週2~4日は出張(日帰り/宿泊含む、担当プロジェクトによっては海外出張の可能性もあり)
担当する施設数 平均4~6施設、経験に応じプロジェクト管理、CRO管理の可能性もあり。■休日:完全週休二日制
- 求める経験
-
...
<必須要件>
・モニター経験のある方(モニタリング業務を一通り経験している人)
・ビジネスで英語の使用経験のある方 読み書き(英文でメールのやりとりができる程度)は必須。
・Excel、Word、PowerPointなどのPCスキル
<望ましい要件>
・理工系学部卒以上(医・薬・農・理工系修士卒以上がより望ましい)
・TOEIC700点以上、英語でのMTGに参加できる方■職種未経験者:不可
- 想定年収
- 508万円 - 683万円
- 語学力
-
英語力:初級以上
臨床開発モニター
- 採用企業名
- EAファーマ株式会社
- 職種
-
メディカル・バイオ - 臨床開発モニター
- 雇用形態
- 無期雇用
- 勤務地
-
東京都
- 仕事内容
-
...
【業務詳細】
・臨床試験の実施に関わる医療機関との交渉・調整、データ収集(モニタリング)
・CRO/ベンダーの管理(海外対応含む)
・臨床開発業務全般
・臨床開発戦略・全体計画の策定・推進
・治験実施計画書の作成
・PMDAからの照会事項に対する対応
・パートナー企業との調整(海外対応あり)
【業務の特徴・魅力】
同一組織(臨床開発グループ)において、臨床開発戦略の策定、臨床試験計画の作成・実施を行うため、開発の経緯や試験計画の背景を深く理解したうえでモニタリング業務を実施することが可能です。
また、モニタリングに限らない幅広い臨床開発業務を知ること、経験を積むことが可能です。
さらに、部内の各機能担当者や他部門(非臨床、CMC、薬事、マーケティング)と連携してプロジェクトを推進することで幅広い知識、多角的な視点を身に着けることができます。■休日:土, 日, 祝日, 夏季休暇, 年末年始
- 求める経験
-
...
【求める経験・能力・スキル】
・臨床開発におけるモニタリング担当者として5年以上の実務経験
・コミュニケーション能力
<尚可>
・チームリーダーの経験を有することが望ましい
・英語でのコミュニケーション能力を有することが望ましい■職種未経験者:不可
- 想定年収
- 560万円 - 800万円
- 語学力
-
英語力:中級以上<英語力>
中級程度(業務上、英語の報告書やメールの読み書きに困らないレベル)
■Clinical Trial Manager(~Senior)
- 採用企業名
- サイネオス・ヘルス・ジャパン株式会社
- 職種
-
メディカル・バイオ - 臨床開発モニター
メディカル・バイオ - 臨床開発リーダー・臨床開発プロジェクトマネージャー
- 雇用形態
- 無期雇用
- 勤務地
-
大阪府
- 仕事内容
-
...
JOB SUMMARY
The Senior Clinical Trial Manager ( CTM) serves as the clinical functional lead, accountable for the clinical
monitoring/site management delivery of assigned tasks and project(s) as per scope. The Senior CTM may
provide oversight and coordination of CTM(s) working across regions and/or countries to ensure clinical
project and site deliverables are met. The position provides leadership, mentoring, and technical support
to the Clinical Operations team to ensure quality deliverables and achievement of milestones and
financial goals. May provide administrative line management, which includes oversight of training,
compliance, performance, development and career management of direct reports.
JOB RESPONSIBILITIES
As defined by scope may be responsible for team member clinical/site management project deliverables
as the clinical functional team leader. Drives and manages the clinical and site management aspects of
assigned project. May be a standalone lead or part of a regional or global clinical functional lead team.
Reviews the study scope of work, budget and protocol content and ensures the clinical project team
(CRAs/CMAs/SMAs) is aware of the parameters. Escalates to the PM any clinical/site management
deliverables (timeline, quality, and budget) at risk, and any activities and requests which are out of
contracted scope. Ensure alignment of clinical activities to budget, including identification of out of scope
activities.
Globally reviews Clinical Trial Management System (CTMS), Case Report Form (CRF), drug
management, safety, Trial Master File (TMF), IVRS/IWRS enrollment, Strategic Data Monitoring
(SDM) and/or other dashboards to oversee site and project team conduct, ensures timely entry of
all operational aspects (required visits, duration, and frequency) according to plan, and identifies
risks to delivery or quality.
Coaches and mentors CTMs regarding functional clinical delivery, evaluation of project risks, and
action implementation. Also sets priorities for the CTM team to complete and manage on a regional
and site level.
Ensure quality of the clinical monitoring and site management deliverables within a project and/or
program and maintain proper visibility of its progress by the use approved systems and / or tracking
tools. May include the development of the Clinical Management Plan (CMP)/Site Management
Plan (SMP).
Understands the monitoring strategy required for the project and, where required, participates in the
development of the project risk assessment plan. Is accountable for the clinical teams’
understanding, ongoing compliance and delivery, according to the stated monitoring strategy,
CMP/SMP, and risk plans
Reviews the content and quality of site monitoring documentation (site monitoring calls, site visit
reports, site letters, and pertinent correspondence), to ensure they represent site management
activities and conduct. Ensures these deliverables are provided according to company and/or
sponsor specifications, including delivery deadlines
Maintains compliance on the project(s) for performance deliverables, and associated KPIs.
Interact with the client and other functional departments related to clinical monitoring and site
management activities and deliverables.
Collaborates with other functional areas to ensure site compliance and delivery according to
protocol, ICH/GCP and/or Good Pharmacoepidemiology Practices (GPP) and country regulations,
including medical monitoring, Safety, Quality Assurance (QA). Ensures Inspection Readiness for
Clinical Scope.
Ensures alignment of clinical activities to budget, including identification of out of scope activities.
As required, provides development and delivery of initial and ongoing training to the study team
regarding protocol specifics, Case Report Form (CRF) completion, Sponsor Standard Operating
Procedures (SOPs), clinical plans and guidelines, data plans and timelines for the project. Plans
and leads regular clinical project team calls to provide status updates, ongoing training and
accountability to deliverables.
As defined by scope may oversee the global project process and status of monitoring and data flow.
Reviews status and trends at the study level, holds CTM team accountable to manage at site and
regional level for effective and timely Source Document Review (SDR) and/or Source Document
Verification (SDV) and data flow, reviewing status of site and project eCRF entry, SDV, triggered
monitoring conduct, query response, and data cleanliness. Proactively collaborates with data
management functional lead to plan towards data cut and lock deadlines. Develops and executes
corrective action plans at study (global) level to address any issues.
May evaluate staff’s competency to perform visits/site contact independently via sign-off visits and
Monitoring Evaluation Visits (MEVs) according to company standards and process.
May participate in business development activities including project clinical operations/site
management strategy and budget input, defense meetings and proposal development.
May be involved in Business Unit or corporate initiatives, serving as a Clinical Operations SME.■休日:完全週休二日制, 土, 日, 祝日, GW, 夏季休暇, 年末年始
- 求める経験
-
...
Bachelor’s degree or RN in a related field or equivalent combination of education, training and
experience
Prior line management experience preferred
Demonstrated ability to independently lead and align teams in the achievement of project milestones,
demonstrates accountability and ability to manage a global clinical operations team.
Knowledge of clinical project financial principles
Knowledge of Good Clinical Practice/ICH Guidelines and other applicable regulatory requirements
Must demonstrate good computer skills and be able to embrace new technologies
Excellent communication, presentation and interpersonal skills among all internal and external
customers
Subject Matter Expert of Clinical Operational process and delivery. Apply problem solving techniques
to independently resolve complex issues and apply a risk management approach to identifying and
mitigating potential threats to the successful conduct of a clinical research project
Demonstrates critical thinking to determine the cause and appropriate solution in the identification of
issues. Able to present solutions and influence other stakeholders to accept those recommendations.
Moderate travel may be required, approximately 20%
Demonstrates adaptability to change and serves as change agent to lead team members to adoption■職種未経験者:不可
- 想定年収
- 800万円 - 1500万円
- 語学力
-
英語力:中級以上
FSP CRA
- 採用企業名
- サイネオス・ヘルス・ジャパン株式会社
- 職種
-
メディカル・バイオ - 臨床開発モニター
- 雇用形態
- 無期雇用
- 勤務地
-
大阪府 東京都
- 仕事内容
-
...
医薬品の臨床開発におけるモニタリング業務を担当していただきます。
基本的にはグローバル治験(国際共同治験)が中心です。外資系製薬会社から受託しているプロジェクトの治験実施計画書に基づき業務を行っていただきます。
■具体的な仕事
・治験を実施する医療機関への治験依頼
・実施医療機関への治験依頼や医師の選定
・治験薬の交付
・症例報告書の回収及び点検
・治験の終了手続きなど■休日:完全週休二日制, 土, 日, 祝日, GW, 年末年始
- 求める経験
-
...
臨床開発モニタ―としてグローバルスタディ2年以上
立ち上げ経験■職種未経験者:不可
- 想定年収
- 600万円 - 800万円
- 語学力
-
英語力:初級以上
【外部就労/派遣】内勤CRA
- 採用企業名
- 非公開
- 職種
-
メディカル・バイオ - 臨床開発モニター
- 雇用形態
- 無期雇用
- 勤務地
-
東京都
- 仕事内容
-
...
( 業務内容 )
・施設との契約交渉・費用交渉
・施設立ち上げ時治験関連文書や資料作成(契約書、IRB資料作成等)
・資料のレビューおよびチェック
・CRAや医療機関と各種調整業務
・治験関連書類の品質管理
・治験関連書類の整備、管理
・施設事務局対応
・SOP管理
・PLサポート(ベンダー管理)
※モニター経験がある方だからできる下記内勤業務です。
※RSM(リモートサイトモニター)とも言われています。
~このような方にお勧めです。~
・臨床開発モニター経験があって、今後は内勤として勤務したいと考えている方
・モニター経験を、さらにキャリア・アップしたいと考えている方
・内勤職としてQCやDMを希望したが、QCでは希望年収合わず悩んでいる方。
・DMでは未経験ではなかなか入れるところがないと考えている方。
・CTA職として希望したが、給与が下がるので難しいと考えている方。
・このままCRAとして勤務継続をするには体力的に難しいと考えている方。■休日:週休二日制
- 求める経験
-
...
・CROでの医薬品臨床開発試験/臨床開発CRA1年以上のご経験
■職種未経験者:不可
- 想定年収
- 450万円 - 650万円
- 語学力
-
英語力:初級以上
【外部就労/派遣】【受託 臨床研究】PL・CRA
- 採用企業名
- 非公開
- 職種
-
メディカル・バイオ - 臨床開発モニター
メディカル・バイオ - 臨床開発リーダー・臨床開発プロジェクトマネージャー
- 雇用形態
- 無期雇用
- 勤務地
-
東京都
- 仕事内容
-
...
★複数ポジション募集中★
■外部就労型:臨床開発モニター(CRA)
⇒外資系・内資系製薬会社で臨床開発モニターとして勤務していただきます
描いたキャリアに沿った派遣先を提案させて頂きます
※必要条件を満たす方であれば面接確約いたします
■ポジション指定/外部就労型:リードモニター(lead CRA)
⇒派遣先内資系企業でリードモニターとして勤務していただきます
⇒部下2名のOJTや教育+CRAとして試験を実施していただきます
・外部就労の場合は、製薬メーカーでの勤務となりキャリアアップを目指すCRAには最適の環境をご提供いたします
・CRA経験が浅い方は、受託型CROでの外部就労から経験を積んでいただくことも可能です
・派遣期間中も定期面談・継続研修等を通じ手厚くサポートいたします
・同社は東証一部上場企業のクオールホールディングスの事業会社です
■外部就労型:サブPL
・症例登録促進のための治験実施施設に対する症例プッシュ訪問
・外注先のCRO及びCRAメンバーのマネジメント、コントロール
・SOPに規定されているCRO−CRAに対するSponsor Oversight Visit
・承認申請を想定しPMDA査察に向けたGCP必須文書の品質管理
・PLのプレゼン資料や週報、各会議の議事録、各種資料の作成
■受託型:臨床研究モニター(CRA)■休日:週休二日制
- 求める経験
-
...
・CROでの医薬品臨床開発試験/臨床開発CRA経験者
※1試験以上の試験完遂の実務 または 選定から終了まで一連の開発プロセス経験
ご経験値に応じて、最適なキャリアをご提案いたします。■職種未経験者:不可
- 想定年収
- 450万円 - 800万円
- 語学力
-
英語力:初級以上
(Senior) Clinical Research Associate
- 採用企業名
- 外資製薬企業
- 職種
-
メディカル・バイオ - 臨床開発モニター
- 雇用形態
- 無期雇用
- 勤務地
-
東京都
- 仕事内容
-
...
Essential Functions of the job:
Conducts monitoring (pre-study, initiation, routine monitoring, and closeout visit), if require
Conducts co-monitoring visits, if required
Assists with investigator/site identification
Assists site to prepare Institutional Review Board/Ethics Committee (IRB/EC) submissions
Facilitates clinical trial site contract and budget negotiation
Manages site queries and communications
Assists in managing clinical trials, if required
Establishes regular lines of communication with sites and CSMs
Provides protocol and related study training to assigned sites
Evaluates the quality and integrity of site practices – escalating quality issues as appropriate
Manage the progress of assigned studies by tracking regulatory submissions and approvals, recruitment and enrollment, case report form (CRF) completion and submission, and data query generation and resolution.
Performs QC of Trial Master Files; creates, maintains, and closes out TMFs; is key in set up, conduct, and close out of ancillary services for studies
Independently deliver clinical start-up component of assigned sites with accountability for time, cost and quality for assigned activities, which include, but not limited to,
Investigator/Site identification, including conduct feasibility activity to identify investigators and conduct site visit to confirm qualification for the required study.
Prepare, review, submit and QC submissions to Institution Review Board (IRB) to obtain clinical trial authorizations and approvals
Prepare, review, and approve site level critical documents for IP release.
Develop and finalize Country and Site-Specific ICFs.
Perform site contract/ budget negotiation during start-up and maintenance phase. (If required)
Review and finalize subject compensation rule and insurance as per local regulations.
Review and translate subject recruitment materials as per local regulations if required.
Assist CSMs in managing clinical trial during startup phase.
Assist in maintain and update company-level investigator database.
Establish, maintain and enhance relationship with key opinion investigators and sites.
Proactively identify potential issues and seek improvement. Take initiative for issue resolution. Coordinate the risk management process encompassing proactive risk identification, evaluation (probability and impact) and mitigation plans.
Performs QC of Trial Master Files; creates, maintains, and closes out TMFs; is key in set up, conduct, and close out of ancillary services for studies.
Perform other duties as assigned by management
Description for focusing on Japan:
Supports to build Japan organization and required process such as Local SOP and WI.
Supports rCSM to perform county activity for new studies if required.
Conducts Site Motivation visits.
Prepares and supports PMDA inspection.
Other tasks, if needed.
Supervisory Responsibilities: Not applicable
Travel: up to 40-70% time, as required■休日:完全週休二日制, 年末年始
- 求める経験
-
...
Qualification Required:
Education Required:
BS in a relevant scientific discipline and at least 3 years or more (CRA) monitoring experience in the pharmaceutical or CRO industry
Experience in oncology global trials preferred
Other Qualifications:
Understands clinical trial processes with a thorough knowledge of ICH and associated regulatory guidelines
At least 3 years or more (CRAII) monitoring experience in the Pharmaceutical or CRO industry
Excellent communication and interpersonal skills
Excellent organizational skills and ability to prioritize and multi-task
Fluent in English (writing and speaking)■職種未経験者:不可
- 想定年収
- 600万円 - 900万円
- 語学力
-
英語力:中級以上
Clinical Research Associate (CRA) / CRA Lead 【関東窓口】
- 採用企業名
- ICONクリニカルリサーチ合同会社
- 職種
-
メディカル・バイオ - 臨床開発モニター
メディカル・バイオ - 臨床開発リーダー・臨床開発プロジェクトマネージャー
- 雇用形態
- 無期雇用
- 勤務地
-
大阪府 東京都
- 仕事内容
-
...
【臨床開発モニター/モニターリーダー】
Global⼜はLocal試験におけるCRA業務
・担勠する試験の進捗状況についてOn-site⼜はOff-siteで監視し、治験実施計画、SOPs、ICH/J-GCP、
その他の適用される法規則に沿って、試験が実施、記録、報告されていることを保証する。
・医療務関との契約交渉、締結に責任を有する。
・他のクリニカルチームメンバーと緊密に連携して、発⽣した試験実施上の問題について、適時の解決を図る。
・経験の浅いメンバーに適切な指導を与え、メンバーの成⻑に貢献する。
※会社の仕組みづくり・プロセスづくりにも携わっていただけます。
※組織を牽引していく、リーダー、マネージャー候補の採用も同時に検討されています。■休日:完全週休二日制, 土, 日, 祝日
- 求める経験
-
...
【学歴:必須要件】
大学卒又は医療系(看護師、臨床検査技師等)の資格保有者
【職務経験等:必須要件】
製薬会社、CROにおける2年以上のCRA経験
業務に支障にならない英語読解力(writing and reading skill)
【職務経験等:望ましい要件】
他のCRAを指導、育成した経験■職種未経験者:不可
- 想定年収
- 500万円 - 1000万円
- 語学力
-
英語力:初級以上
【R&D】Clinical Site Lead (BioPharma), Site Management & Monitoring Group, BioPharma Clinical Operations, Development Operations
- 採用企業名
- アストラゼネカ株式会社
- 職種
-
メディカル・バイオ - 臨床開発モニター
- 雇用形態
- 無期雇用
- 勤務地
-
大阪府 東京都
- 仕事内容
-
...
【職務内容 / Job Description】
Clinical Site Lead (CSL) is a field-based role within Site Management & Monitoring (SMM) at AstraZeneca K.K., dedicated to supporting clinical trials within Japan. The CSL will be assigned to dedicated disease area and proactively drive site performance, enhance site engagement, and foster strong relationships with investigators and site staff based on enhancing knowledge at the specific disease area. The CSL will focus on driving recruitment performance and ensuring strong CRO oversight, without direct site management and monitoring responsibilities. This role will contribute to operational feasibility assessments and provide input on recruitment and retention strategies as well.
【Key Responsibilities】
•Planning: Contribute to the accurate site and recruitment plan
•Partnerships: Establish strategic partnership models and frameworks for deployment across key clinical sites and investigators.
•Communication: Maintain awareness of market activities, policies, trends, technologies, and information affecting the business, to support the ongoing improvement of clinical recruitment efforts in line with company policies
•Strategic Input: Provide SMM input to clinical study documents, including Clinical Study Protocol (CSP), Informed Consent Form (ICF), and Monitoring Plan.
•Performance Monitoring: Monitor study progress, including country start-up, site activation, and recruitment
•Risk Management: Track study performance and delivery risks, and work alongside LST and GST to develop and implement mitigation plans.
•When the CSL is assigned to induvial clinical study, having full responsibility for the site and study management from AZ KK, the CSL will take following responsibilities.
•Lead and manage all activities related to site management and monitoring including the following with agreed timelines and company standard quality in Japan.
•Plan and deliver a site selection strategy
•Plan patient recruitment strategy including SMO managements and following patient recruitment progress
•Lead and manage CRAs including CRO CRAs to deliver clinical study data
•Develop and manage risk mitigation plans and contingency plans to execute site managements and monitoring from site qualification to site close on time.
•Lead and manage the quality of clinical study data.
•Lead and manage queries and quality issues related to site management and monitoring together with CRAs.
•Contribute to regulatory inspection in the area of site management and monitoring from study set up through conduct and inspection readiness.
•Escalate issues related to site management and monitoring to an appropriate person and contribute to resolve.
•Lead certain number of CRAs (incl. CRO CRAs) to in terms of information management and communication related to site management in study team to keep monitoring quality.
•Contribute to the development of Development Operations Japan by joining some projects or initiatives, e.g. Process Ownership responsibilities, CRA training.
•Contribute or encourage to innovate clinical trial environment with new technologies which AZ will implement, cooperating with study sites and sites’ staff.■休日:完全週休二日制, 年末年始
- 求める経験
-
...
■ 経験 / Experience
<必須 / Mandatory>
•At least 3-years’ experience in pharmaceutical industries or clinical research organization, preferably in Clinical Operations (CRA, Senior CRA)
•Demonstrated leadership capability in a team environment successfully.
•Negotiated some complicated issues and/or requirements with site staff.
•Team oriented and flexible; ability to respond quickly to shifting demands and opportunities.
<歓迎 / Nice to have>
•Preferred experience to collaborate with external partners.
•Performed monitoring activities from qualification visit to closure visit as a CRA.
■Education
<必須 / Mandatory>
•Bachelor’s degree in a related discipline, preferably in life science, or equivalent qualification
■能力 / Skills and capabilities
<必須 / Mandatory>
•Personal Effectiveness & Drives Accountability in Others
•Learning Agility
•Financial, Technology & Process Competency
•Communication & Teamwork – Influencing, Collaboration, Business Partnering
•Effective, risk-based thinking – Strategic thinking, Problem Solving, Critical Thinking, Decision Making
•Deliver Priorities Results & Impact – Project Management, Recruitment/Retention Planning & Action
•Act with Integrity & high ethical standards■職種未経験者:不可
- 想定年収
- 600万円 - 940万円
- 語学力
-
英語力:中級以上
【R&D】Senior Clinical Research Associate (SCRA), Development Operations, Site Management & Monitoring Department
- 採用企業名
- アストラゼネカ株式会社
- 職種
-
メディカル・バイオ - 臨床開発モニター
- 雇用形態
- 無期雇用
- 勤務地
-
大阪府 東京都
- 仕事内容
-
...
【職務内容 / Job Description】
Monitor is responsible to ensure that the trial is conducted and documented properly by carrying out the following activities when relevant and necessary to the trial and the trial site in order to verify that:
The rights and well-being of human subjects are protected.
The reported trial data are accurate, complete, and verifiable from source documents.
The conduct of the trial is in compliance with the currently approved protocol/amendment(s), with GCP, and with applicable regulatory requirement(s).
【Key Responsibilities】
• Acting as the main line of communication between the sponsor and the investigator.
• Communicate with Japan Study Leader and third party vendors as needed.
• Conduct site selection activities for verifying adequate qualifications.
• Manage and monitor the responsible sites and ensure their quality appropriately, agreed cost spent and on a timely basis by conducting the followings;
Manage the contracts of clinical trial with the responsible site and ensure the compliance with regulations and company-wide governance controls such as Ethical Interactions policy or company-legal standard.
Input appropriate information in order to create clinical trial related documents (ex. CSP, IND).
Ensure a steady implementation of supplying clinical site with study materials.
Provide investigators and site staff with education and training regarding study specific procedures including EDC system.
Manage the patient recruitment status and request acceleration of patient recruitment for Investigators and site staff.
Conduct source data verification and ensure data quality to collect appropriate clinical study data.
If necessary, support sites to ensure sites understand and resolve data queries in a timely manner.
Ensure that essential documents and source data are appropriately stored in a clinical site.
Produce monitoring activity reports appropriately and in a timely manner.
Confirm and ensure status of GCP/ICH guidelines, CSP and AZ policy compliance.
Report critical and/or serious issues relating to site management to the study team and line manager in a timely manner.
• Ensure input the latest site related information in IMPACT at appropriate timing.
• Participate in-house and/or external clinical trial related meeting (ex. Study team meeting, CRA’s meeting, Investigators’ meeting) including the preparations.
• Cooperate with site audit in liaison with QA and a site inspection by regulatory authority.
• Cooperate with resolving the result of SAE reconciliation.
• Ensure inspection ready TMF regarding site related documents.
In addition to above, Senior CRA also is to
• Lead a certain number of CRAs (incl. CRO CRAs) to in terms of information management and communication related to site management in study team to keep monitoring quality.
• Taking some tasks delegated by Study Leaders if agreed.
• Contribute to the development of Clinical Operations Japan by joining some projects or initiatives, e.g. Process Ownership responsibilities, CRA training.
• Mentor CRAs on monitoring and internal procedures.■休日:完全週休二日制, 年末年始
- 求める経験
-
...
【経験 / Experience】
<必須 Mandatory : Required only for Senior role>
• At least 3 years of CRA experience.
• Demonstrated leadership capability in a team environment successfully.
• Negotiated some complicated issues and/or requirements with site staff.
• Team oriented and flexible; ability to respond quickly to shifting demands and opportunities
(Cumulativeでなく、随時担当しているような経験)
・症例数 30前後
・施設数 4以上
・投薬例数 20以上
<歓迎 Nice to have: Preferred only for Senior role>
• Preferred experience to collaborate with external partners.
• Performed monitoring activities from qualification visit to closure visit as a CRA.
・症例数:30前後
・施設数:4以上
・投薬例数:20以上
【Education】
<必須 Mandatory>
• Bachelor’s degree (or equivalent), preferably in biological science or discipline associated with clinical research
【能力 / Skills and capabilities】
<必須 Mandatory: Required for CRA>
• Communication skill
• Negotiation skill
• Spirit of inquiry
• Ability to manage for delivering the clinical study data.
• Ability to plan effective monitoring activity
• Ability to build and manage effective relationship with Investigators and site staff
• Consistently exhibits Leadership capability as below:
Drives Accountability - focuses on delivery/results; holds self accountable: Stretches and challenges self to meet or exceed high standards of behaviour and outcomes in line with AZ Values.
Works Collaboratively - seeks diverse views: shares and seeks out diverse views, incorporating them where appropriate in order to develop better proposals and creative solutions for the business
<必須 Mandatory: Required for Senior role>
• Demonstrate superior site monitoring and management skills at the site level covering more sites with multiple protocols compared to CRAs.
• Examine issue signals and resolve them with appropriate resolution and timing.
• Effective problem and conflict resolution skills especially for CRA/Site related issues. Collaborate with other function's experts, if needed.
• Ability to share best practice and lessons learnt actively to improve quality and productivity of the wider monitoring team.
• Excellent written and verbal communication skills as well as proven negotiation, collaboration and interpersonal leadership skills
• Influencing-recognize the positive impact of own words, actions and personal presentation on others (ex. Study team, Other study teams, Clinical Operation). And also, be able to present/explain an appropriate behavior to influence others.
• The ability to build and manage effective relationship with CRO to keep monitoring quality.
• Consistently exhibits Leadership capability as below
Drives Accountability - focuses on delivery/results; holds others accountable: communicated clear expectations of behavior and outcomes as well as why these standards matter. Holds others to account for delivering them
Works Collaboratively - encourages diverse views/thinking; creates environment in which diverse viewpoints are sought and encouraged, both within beyond the team including with external partners.
Strategic Leadership – clarifies complexity: thinks more broadly than their role (e.g. externally) and uses this insight to challenge and adapt current approaches in one’s area in an effort to simplify complexity and/or ensure alignment
Acts Decisively – Takes Calculated Risk: Makes effective decisions despite uncertainty and/or incomplete information to drive business outcomes. Communicates learly to ensure alignment and empowers others with decision-making authority as appropriate.■職種未経験者:不可
- 想定年収
- 600万円 - 940万円
- 語学力
-
英語力:中級以上
Clinical Trial Manager
- 採用企業名
- バイオベンチャー
- 職種
-
メディカル・バイオ - 臨床開発モニター
メディカル・バイオ - 臨床開発リーダー・臨床開発プロジェクトマネージャー
- 雇用形態
- 無期雇用
- 勤務地
-
東京都
- 仕事内容
-
...
【所属部署の業務分掌】
・臨床試験の計画、実施(国内試験、グローバル試験)
・規制当局(PMDA, FDA 等)との相談の準備、実施
・CTD(臨床パート)の作成
・承認申請後の当局対応(規制当局との面談、照会事項回答作成 等)
・機構の適合性調査の準備、対応
【本ポジションに期待する役割】
本承認取得に向けた製造販売後臨床試験プロジェクトに参画し、下記のような役割を担っていただきます。
① 臨床試験計画に基づき、合意されたタイムライン、予算内、品質での臨床試験実施
② 機構相談実施、臨床試験実施、製造販売承認申請、GCP実地調査/適合性書面調査対応、照会事項回答等のための資料作成
また、海外展開を行うために、治験実施計画のFDA承認取得プロジェクトに参画いただきます。
【職務内容詳細】
① 臨床試験の実施に際し、CRO、 ベンダー、試験実施施設を監督し、リスクを特定して運用上の問題を解決することで、試験の進捗をモニタリングする。
② 合意されたスケジュール、予算、および社内標準の品質で、試験実施施設の管理とモニタリングに関する全てのアクティビティを主導し管理する。
③ 施設選定/被験者募集戦略の立案及び実施する。
④ 問題をタイムリーに解決することにより、臨床試験データの質を確保する。
⑤ CROが試験実施施設の管理を実行するためのリスク軽減プランとコンティンジェンシープランの作成と管理を行う。
⑥ 信頼性保証部門と協力して、外部/内部監査に関連する活動をリードし、割り当てられたプロジェクトに関して規制当局の査察対応に貢献する。
⑦ すべての試験関連文書が最終保管されていること、そしてTMFが完成していることを保証する。
⑧ 試験実施計画書、同意説明文書作成への関与、日本語と英語間の翻訳を保証する。
⑨ 試験の管理に関する課題のエスカレーションを行なうとともに、課題解決に貢献する。
⑩ CROや中央検査機関等のビジネスパートナーとのコミュニケーションや交渉を行い、社内クロスファンクショナルチームやKOLとの調整を行う。
⑪ 臨床開発計画立案及び機構相談資料、試験総括報告書、CTD、照会事項回答作成に関与する。
⑫ 臨床開発業務関連SOPや様式の作成及びメンテナンスを行う。
⑬ その他、臨床開発部長のサポートを行う。■休日:完全週休二日制, 夏季休暇, 年末年始
- 求める経験
-
...
Senior Clinical Trial Managerの要件となります。
※年数・PJ数は目安となります。
【求める経験】
・Project Lead/Project Managementの経験 5年以上
・CRAの経験かつClinical Trial Manager (CTM)の経験 5年以上
・製薬会社の臨床開発部門での業務経験 5年以上
・製薬会社におけるCROのマネジメント経験 2試験以上
・PMDAのGCP実地調査/書面適合性調査の実務担当者としての経験 2プロジェクト以上
・機構相談資料、治験総括報告書、CTD作成の経験 1プロジェクト以上■職種未経験者:不可
- 想定年収
- 850万円 - 1500万円
- 語学力
-
英語力:中級以上求めるスキル:TOEIC 800点以上(ビジネス英会話レベル)
薬事担当
- 採用企業名
- 医療機器商社
- 職種
-
メディカル・バイオ - 臨床開発モニター
メディカル・バイオ - 薬事申請
- 雇用形態
- 無期雇用
- 勤務地
-
大阪府
- 仕事内容
-
...
医療機器の薬事申請に関わる業務全般をお任せいたします。
薬事承認・認証申請書の作成および申請
申請書作成に必要な製品に関する情報・データの収集、関連部署(海外メーカー含む)との連携
PMDA、認証機関等の規制当局と折衝、照会
規制当局の査察・監査等の対応
薬機法および関係規制に関する情報収集
申請要件のアドバイス等、製品開発のサポート■休日:完全週休二日制, 土, 日, 祝日, GW, 夏季休暇, 年末年始
- 求める経験
-
...
■理工系(医学/物理学/化学/生物/薬学/工学)大学卒以上
■基本的なPC スキル(ワード、エクセル、パワーポイント)
■薬事(申請、QMS、GVP 等)に関する業務経験
■英語:中級以上 ※読み書き
■医療機器/医薬品の薬事申請業務の経験(※医療機器/医薬品以外でも可)
■監督官庁・認証機関との業許可、申請に関わる業務経験
■薬機法、QMS 省令に関する知識
■GMP、 QMS、GVP 等に関する業務経験■職種未経験者:不可
- 想定年収
- 480万円 - 640万円
- 語学力
-
英語力:初級以上語学力: 要
文書読解レベル
【Real-World Evidence Services疫学研究・市販後試験部門】CPM (Clinical Project Manager)
- 採用企業名
- IQVIAサービシーズ ジャパン合同会社
- 職種
-
メディカル・バイオ - 臨床開発モニター
メディカル・バイオ - 医療機器モニター
メディカル・バイオ - 臨床開発リーダー・臨床開発プロジェクトマネージャー
- 雇用形態
- 無期雇用
- 勤務地
-
東京都
- 仕事内容
-
...
【業務内容】
倫理指針または臨床研究法下で実施される臨床研究のプロジェクトマネジメント・プロジェクト体制全体を構築・管理
・試験に関わる各種プランの立案(リスクマネジメントプランなど)
・試験タイムライン・マイルストンに対する責任者
・文書全体管理、予算・請求管理
・各ファンクションの統括
・ベンダーとのコミュニケーション
・クライアントとの主な連絡窓口
■Real-World Evidence Servicesについて
医療経済・アウトカム研究(HEOR)、疫学、医薬品の安全性、リアルワールド・エビデンス(RWE)などに特化したスペシャリストが、世界各国の拠点で活動するIQVIA。プロトコルから統計解析、パブリケーションまでリアルワールド・エビデンス創出を包括的にサポートし、科学的根拠に基づく意義あるインサイトを提供します。当該ポジションは、その一手を担うポジションとなります。(GPSPに準拠した製造販売後データベース調査も対応)
【会社紹介・ビジョン】
私たちIQVIAは、ヒューマンデータサイエンスの先駆的な企業として、医療・ヘルスケアの前進に取り組む皆様をIQVIAならではの革新的なソリューションによってご支援することで、「誰もが、より健康に自分らしく生きられる社会」の実現を目指しています。世界最大規模を誇る医療・ヘルスケア関連データを基盤に、人・データ・サイエンスを融合させた見地から、未だ満たされない治療ニーズに応える、新たな医薬品や医療機器の開発と市販化、厳格化する規制やコンプライアンスへの対応、持続可能な医療システム推進の支援など、患者さんをはじめとするすべての人々のために、より良い未来へと医療・ヘルスケアを前進させていく力となることが、私たちの使命です。
世界100以上の国と地域で約9万人が活動するIQVIAの日本法人として、IQVIAジャパンでは約6,000人が一丸となり、この使命に向かって日々、力を尽くしています。
- 求める経験
-
...
<必須要件>
クリニカルまたはリアルワールド部門での
・Project Manager経験(試験立案から論文作成までの流れを熟知)
・進捗管理及び関連部署との調整をした経験
・イノベイティブ、提案力のある人
・交渉力
・専門の疾患領域を持っている人
・英語力(読み書きは必須。スピーキングは出来れば尚可)■職種未経験者:不可
- 想定年収
- 900万円 - 1100万円
- 語学力
-
英語力:初級以上
東京本社:臨床開発(治験運営担当)
- 採用企業名
- 富士製薬工業株式会社
- 職種
-
メディカル・バイオ - 臨床開発モニター
その他 - その他
- 雇用形態
- 無期雇用
- 勤務地
-
東京都
- 仕事内容
-
...
当社臨床開発部門にて、治験全体の運営管理やモニタリング業務の管理・サポートを担当いただくポジションです。
外勤や時間外対応が難しい方でも、医薬品開発経験(例:モニター経験)を活かして活躍いただけます。
■主な業務内容
1.治験運営管理
┕スタディーチームミーティング運営
┕リスクマネジメント試験担当者
┕セントラルモニタリング試験担当者
┕治験薬管理担当者(RTSM/IWRSの担当も含む)
┕モニタリング報告書レビュー(症例、スタッフ)
2.オペレーション及びモニタリング業務の管理・サポート
┕契約書関係(リーガルチェック・稟議・捺印)
┕ドキュメント作成
┕進捗管理
┕SSU・CTA対応
3.GCP共通項目や臨床開発部の運営
┕SOP新設・改定時の対応
┕CAPA管理事務局
※上記すべての業務をお任せするわけではなく、経験・スキルに応じてご担当いただく業務を検討いたします。
■中長期的ビジョン
女性医療貢献度No.1を目指し、産婦人科領域では継続して新薬開発とジェネリック品上市を継続してゆきます。もう一つの柱として提携先のアイスランド・アルボテック社から導入するバイオシミラーについては複数品目の国内販売を予定しており、現在その開発が進行中です。
※10年後のあるべき姿を描いた当社の「2035年ビジョン」を当社HPよりご覧いただけます。
https://www.fujipharma.jp/
■当社の強み
領域に特化したメーカーは少なく、医師からの信頼を築きやすいです。また、産婦人科領域は現在、厚生労働省による不妊治療助成金の増額が決まったことや、緊急避妊薬が今後薬局でも取り扱われるようになるなど非常に注目が集まっている領域であり、その中でも当社は日本を代表する産婦人科領域のリーディングカンパニーとしての地位を確立しています。
■キャリアディベロップメント(ジョブローテション)制度
当社では、キャリアディベロップメント(ジョブローテーション)制度が存在し、原則1年に一度、自身のキャリア希望を申請することが可能です。そのため、当社では自身のキャリアパスを自由に挑戦することが可能です。■休日:完全週休二日制, 土, 日, 祝日, 夏季休暇, 年末年始
- 求める経験
-
...
■必須要件
製薬会社またはCROで医薬品開発担当として従事した経験が3年以上あり、かつ以下①~③のいずれかの業務経験がある方
①QMS
②DM(データマネジメント)
③CRA(モニタリング業務)
■歓迎スキル・経験
・GCP、医薬品開発に関連する法令、規制、及びガイドラインに関する高度な知識をお持ちの方
・書面及び口頭でのコミュニケーションを含む優れた対人関係能力
・科学・医学関係の知識を吸収・利用する能力
・複数の業務が並行する中で優先順位を判断し適切に実行できる能力及び目標に対する強いコミット
■求める人物像
・責任感があり、いずれは独力で活躍できそうな方もしくはそのようなイメージで活躍したいと考えられる方
・手順を重んじながらも、重要なポイントを押さえた上で柔軟な考えができる方■職種未経験者:不可
- 想定年収
- 500万円 - 800万円
- 語学力
-
英語力:不問
- 1
- 2
- 3
- 4
- 5
WEBではお伝えできない情報を、
戦略的な観点からお伝えします
JACでは、気になる企業の 同業他社との比較により、その企業や求人の採用傾向など 特長をより明確に知ることができます。
| 求人の観点 | A社 | B社 | CD社・・ |
|---|---|---|---|
| 採用される方の属性 | XXXX | XXXX | |
| 採用される/されない方の違い | XXXX | XXXX | |
| 実年収の高低 | XXXX | XXXX | |
| 企業の戦略・成長性 | XXXX | XXXX |
JACでは、約1,000名ものコンサルタントが直接企業とコンタクトをとり、 求人のスペックだけではなく、社風や部・課・チームの雰囲気など気になる情報もお伝えしております。
| 求人の観点 | A社 | B社 | CD社・・ |
|---|---|---|---|
| 年収傾向 | XXXX | XXXX | |
| 社内・部内の雰囲気 | XXXX | XXXX | |
| 上司の傾向 | XXXX | XXXX | |
| 本社・支社の関係性 | XXXX | XXXX |
JACは複数のコンサルタントが
あなたをスカウト
複数のコンサルタントがサポートするJACのコンサルティング
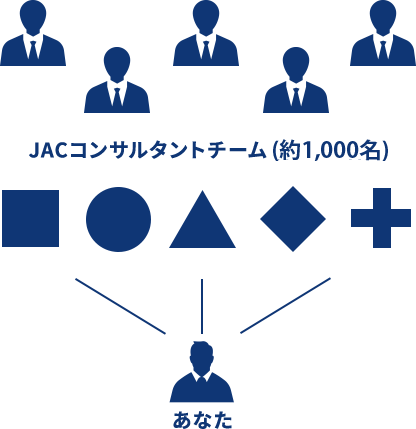
各職種のプロが多角的に
求人を紹介するので、
幅広い選択肢からお選び頂けます。
特定のコンサルタントが担当する一般的な外資系エージェント
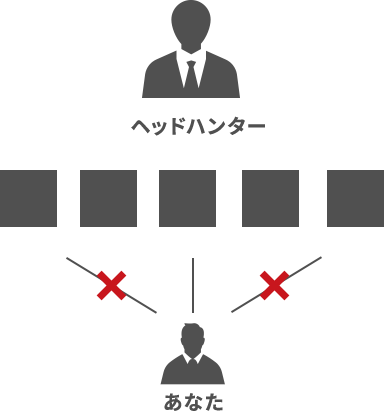
一人のヘッドハンターが選んだ
求人だけなので
偏りや漏れが出ることがあります。
あなたのスキルを活かせる求人&あなたと近しいスキルの方の
「転職成功の傾向」





