求人検索
- 1
- 2
- 3
- 4
臨床開発職
ベトナム事業の推進業務【ロート製薬グループ】
- 採用企業名
- ロートニッテン株式会社
- 職種
-
営業 - 法人営業(その他)
営業 - 海外営業
営業 - OTC営業
営業 - 医療機器営業
営業 - 診断薬営業・ライフサイエンス営業
営業 - 法人営業(消費財)
営業アシスタント・カスタマーサービス - 秘書
営業アシスタント・カスタマーサービス - 秘書(外国人付)
営業アシスタント・カスタマーサービス - 営業アシスタント
営業アシスタント・カスタマーサービス - 一般事務・アシスタント
営業アシスタント・カスタマーサービス - 通訳・翻訳
営業アシスタント・カスタマーサービス - 病院事務・医療事務
技術系(機械設計・製造技術) - 化学(研究・開発・分析)
技術系(機械設計・製造技術) - 食品(研究・開発・分析)
技術系(機械設計・製造技術) - 化粧品(研究・開発・分析)
メディカル・バイオ - 創薬・テクニシャン
メディカル・バイオ - 前臨床(薬効薬理・毒性・ADME)
メディカル・バイオ - 臨床開発モニター
メディカル・バイオ - 医療機器モニター
メディカル・バイオ - 臨床開発QC・GCP監査
メディカル・バイオ - 臨床開発リーダー・臨床開発プロジェクトマネージャー
メディカル・バイオ - 臨床開発メディカルライター
メディカル・バイオ - 医薬品ライセンシング
メディカル・バイオ - メディカルデータマネジメント
メディカル・バイオ - 統計解析
メディカル・バイオ - 薬事申請
メディカル・バイオ - メディカル教育
メディカル・バイオ - 安全性情報(臨床開発・製販後GVP)
メディカル・バイオ - 製造販売後調査(GPMSP)
メディカル・バイオ - メディカルGQP・GMP・品質保証・品質管理
メディカル・バイオ - 流通対策
メディカル・バイオ - CRC・治験コーディネーター
メディカル・バイオ - 管理薬剤師
メディカル・バイオ - テクニカルサポート・アプリケーションスペシャリスト
メディカル・バイオ - クリニカルスペシャリスト
メディカル・バイオ - メディカルサイエンスリエゾン
メディカル・バイオ - 品質保証
メディカル・バイオ - 品質管理
メディカル・バイオ - メディカルアフェアーズ
メディカル・バイオ - CMC薬事
医療・介護・福祉 - 医師
医療・介護・福祉 - 薬剤師
医療・介護・福祉 - 看護師
医療・介護・福祉 - 臨床検査技師
医療・介護・福祉 - 臨床工学技士
医療・介護・福祉 - 管理栄養士
医療・介護・福祉 - 獣医師
医療・介護・福祉 - 介護・福祉関連職
医療・介護・福祉 - 放射線技師
医療・介護・福祉 - 保健師
- 雇用形態
- 無期雇用
- 勤務地
-
愛知県 東京都
- 仕事内容
-
...
同社の東京オフィスあるいは名古屋本社にて、ベトナム関連のプロジェクトに携わっていただきます。
【具体的には】
・ベトナム拠点への医薬品技術の移管
・現地で製造している製品の日本側窓口対応の強化
・社長や役員との現地取引先への同行
・営業事務やベトナム語での通訳業務
名古屋や東京、両拠点への出張やベトナムへの出張も想定しています。■休日:完全週休二日制, 土, 日, 祝日, GW
- 求める経験
-
...
【必須条件】
ベトナム語ビジネスレベル■職種未経験者:不可
- 想定年収
- 450万円 - 550万円
- 語学力
-
英語力:初級以上
RAD026-2025 クロステック開発部 医療・ヘルスケア技術開発・医療・ヘルスケア技術開発担当
- 採用企業名
- 株式会社NTTドコモ
- 職種
-
事業企画・営業企画 - 渉外(ロビイング)
メディカル・バイオ - 臨床開発モニター
メディカル・バイオ - 医療機器モニター
メディカル・バイオ - 臨床開発リーダー・臨床開発プロジェクトマネージャー
メディカル・バイオ - 薬事申請
メディカル・バイオ - 安全性情報(臨床開発・製販後GVP)
メディカル・バイオ - 製造販売後調査(GPMSP)
メディカル・バイオ - メディカルGQP・GMP・品質保証・品質管理
メディカル・バイオ - 品質保証
メディカル・バイオ - 品質管理
- 雇用形態
- 無期雇用
- 勤務地
-
東京都
- 仕事内容
-
...
■組織のミッション
・お客さまの健康と利便性を第一に考え、健康管理から疾患の予防、診断、診療・治療、予後管理までスマートフォンを活用したシームレスな個別化サービスを提供し、医療ヘルスケア領域における社会課題の解決と、商流拡大の両立に挑戦。
・ビジネスパートナーの皆さまと協創することで、お客さまの期待を超える驚きと感動、法令遵守の上で安心・安全・高品質な製品とサービスを提供。
・日常生活しながら誰もが健康を維持・改善できる社会の実現をめざす。
■組織の業務概要
・スマートフォンログから各種健康状態を推定するヘルスケアAIの企画、設計、開発、サービス提供。
・疾患の予防、診断、治療等を目的としたメディカルAIの企画、設計、開発、サービス提供。
・上記の各種AIを実装したクラウドシステム基盤の企画、設計、開発、保守運用。
■担当いただく業務概要
<担当業務>
【下記の業務からスキルや経験に応じてご担当いただきます】
医療機器承認取得や保険収載獲得に向けた
・規制当局との折衝
・厚労省や学会、医師会、業界団体等へのロビー活動
・薬事対応
・臨床試験または治験の企画、設計、運用
・チームリーダーとして業務を牽引、後輩社員の指導・育成
<業務の魅力>
・ドコモだからこそ利用できるスマートフォンから得られるデータを分析して構築した医療機器プログラムとしてのAIを実現し、スマートフォンアプリによる疾患の予防、診断、治療などのデジタル医療の新たな文化を創造して社会に大きなインパクトを与える業務に従事できます。
・医療機器販売業を有するビジネス部門や外部パートナーとも連携しながら、スケールの大きなプロジェクトのリーディング経験を積めます。
■候補者へのメッセージ
健康寿命延伸、医療費抑制、医師不足といった社会課題解決と事業化を両立させる非常にやりがいのあるポストです。
1億会員を超えるお客さまに直接リーチできるスマートフォンを基軸としたアプローチにより、日常生活しながら、誰もが健康を維持・改善できる社会の実現を目ざし、開発体制強化の為、人材募集を行っています。
----------------------------
■働き方の目安(※メンバー(業務・意向)により異なる)
リモートスタンダード適用組織となります。
https://group.ntt/jp/newsrelease/2022/06/24/220624a.html
■勤務地
・自宅(国内限定)
※業務上の必要性により、上長等から出社を命じられる場合有
■勤務地備考
※出社の場合は以下の事業所に出社
・事業所名:山王パークタワー
・住所: 〒100-6190 東京都千代田区永田町二丁目11番1号
・最寄り駅:
銀座線、南北線「溜池山王駅」 直結
丸ノ内線、千代田線「国会議事堂前駅」 直結
・禁煙環境:全面禁煙
■転勤
・数年単位で専門性や適性を軸に異動が発生する場合有
※リモートスタンダード組織への異動の場合、原則転居・転勤は無
※オフィスベース組織への異動の場合、転居が必要となる可能性有(同組織でもリモートワークによる勤務は可)
■出社に伴う費用について
勤務事業所への出社については標準的な出社経路を事前に認定したうえで、
その経路を用いた出社に伴い発生する費用を旅費としてお支払いします。
※新幹線、飛行機の利用も旅費規程に基づく範囲内で利用可となる場合がございます。詳細は個人ごとに異なるため内定後ご説明いたします。
■その他
・業務命令に基づき出社(出張)が発生する場合がございます。
※最低出社日の指定はありませんが、業務状況に応じて出社が命ぜられる頻度が変わる可能性有
・リモートワーク手当有:
200 円 × 「自宅」でのリモートワーク実施日数 (3H 以上)
■残業時間について
・所属先組織の平均残業時間は20H/月程度■休日:完全週休二日制, 夏季休暇, 年末年始
- 求める経験
-
...
<必須>
・知的好奇心が旺盛で、未知の分野へも臆することなくチャレンジしていく積極性を有し、新たな市場を自ら開拓する意欲のある方。
・柔軟性、協調性を持ち、社内外を問わず円滑なコミュニケーションが図れ、困難な状況においても自ら率先して周囲の人を引っ張っていけるリーダーシップを発揮できる方。
・医療/ヘルスケアに対する強い想いをもち、一人称でプロジェクト推進ができる方。
<求めるスキル>
以下のうち、いずれかの経験を3年以上有する方。
医療機器承認取得や保険収載獲得に向けた
・規制当局との折衝
・厚労省や学会、医師会、業界団体等へのロビー活動
・薬事対応
・臨床試験または治験の企画、設計、運用
<その他あると望ましいスキル>
・医療機器製造販売業の安全管理に係る業務経験
・医療機器販売業の営業管理に係る業務経験■職種未経験者:不可
- 想定年収
- 770万円 - 960万円
- 語学力
-
英語力:不問
臨床開発モニター
- 採用企業名
- EAファーマ株式会社
- 職種
-
メディカル・バイオ - 臨床開発モニター
- 雇用形態
- 無期雇用
- 勤務地
-
東京都
- 仕事内容
-
...
【業務詳細】
・臨床試験の実施に関わる医療機関との交渉・調整、データ収集(モニタリング)
・CRO/ベンダーの管理(海外対応含む)
・臨床開発業務全般
・臨床開発戦略・全体計画の策定・推進
・治験実施計画書の作成
・PMDAからの照会事項に対する対応
・パートナー企業との調整(海外対応あり)
【業務の特徴・魅力】
同一組織(臨床開発グループ)において、臨床開発戦略の策定、臨床試験計画の作成・実施を行うため、開発の経緯や試験計画の背景を深く理解したうえでモニタリング業務を実施することが可能です。
また、モニタリングに限らない幅広い臨床開発業務を知ること、経験を積むことが可能です。
さらに、部内の各機能担当者や他部門(非臨床、CMC、薬事、マーケティング)と連携してプロジェクトを推進することで幅広い知識、多角的な視点を身に着けることができます。■休日:土, 日, 祝日, 夏季休暇, 年末年始
- 求める経験
-
...
【求める経験・能力・スキル】
・臨床開発におけるモニタリング担当者として5年以上の実務経験
・コミュニケーション能力
<尚可>
・チームリーダーの経験を有することが望ましい
・英語でのコミュニケーション能力を有することが望ましい■職種未経験者:不可
- 想定年収
- 560万円 - 800万円
- 語学力
-
英語力:中級以上<英語力>
中級程度(業務上、英語の報告書やメールの読み書きに困らないレベル)
FSP CRA
- 採用企業名
- サイネオス・ヘルス・ジャパン株式会社
- 職種
-
メディカル・バイオ - 臨床開発モニター
- 雇用形態
- 無期雇用
- 勤務地
-
大阪府 東京都
- 仕事内容
-
...
医薬品の臨床開発におけるモニタリング業務を担当していただきます。
基本的にはグローバル治験(国際共同治験)が中心です。外資系製薬会社から受託しているプロジェクトの治験実施計画書に基づき業務を行っていただきます。
■具体的な仕事
・治験を実施する医療機関への治験依頼
・実施医療機関への治験依頼や医師の選定
・治験薬の交付
・症例報告書の回収及び点検
・治験の終了手続きなど■休日:完全週休二日制, 土, 日, 祝日, GW, 年末年始
- 求める経験
-
...
臨床開発モニタ―としてグローバルスタディ2年以上
立ち上げ経験■職種未経験者:不可
- 想定年収
- 600万円 - 800万円
- 語学力
-
英語力:初級以上
【外部就労/派遣】内勤CRA
- 採用企業名
- 非公開
- 職種
-
メディカル・バイオ - 臨床開発モニター
- 雇用形態
- 無期雇用
- 勤務地
-
東京都
- 仕事内容
-
...
( 業務内容 )
・施設との契約交渉・費用交渉
・施設立ち上げ時治験関連文書や資料作成(契約書、IRB資料作成等)
・資料のレビューおよびチェック
・CRAや医療機関と各種調整業務
・治験関連書類の品質管理
・治験関連書類の整備、管理
・施設事務局対応
・SOP管理
・PLサポート(ベンダー管理)
※モニター経験がある方だからできる下記内勤業務です。
※RSM(リモートサイトモニター)とも言われています。
~このような方にお勧めです。~
・臨床開発モニター経験があって、今後は内勤として勤務したいと考えている方
・モニター経験を、さらにキャリア・アップしたいと考えている方
・内勤職としてQCやDMを希望したが、QCでは希望年収合わず悩んでいる方。
・DMでは未経験ではなかなか入れるところがないと考えている方。
・CTA職として希望したが、給与が下がるので難しいと考えている方。
・このままCRAとして勤務継続をするには体力的に難しいと考えている方。■休日:週休二日制
- 求める経験
-
...
・CROでの医薬品臨床開発試験/臨床開発CRA1年以上のご経験
■職種未経験者:不可
- 想定年収
- 450万円 - 650万円
- 語学力
-
英語力:初級以上
【外部就労/派遣】【受託 臨床研究】PL・CRA
- 採用企業名
- 非公開
- 職種
-
メディカル・バイオ - 臨床開発モニター
メディカル・バイオ - 臨床開発リーダー・臨床開発プロジェクトマネージャー
- 雇用形態
- 無期雇用
- 勤務地
-
東京都
- 仕事内容
-
...
★複数ポジション募集中★
■外部就労型:臨床開発モニター(CRA)
⇒外資系・内資系製薬会社で臨床開発モニターとして勤務していただきます
描いたキャリアに沿った派遣先を提案させて頂きます
※必要条件を満たす方であれば面接確約いたします
■ポジション指定/外部就労型:リードモニター(lead CRA)
⇒派遣先内資系企業でリードモニターとして勤務していただきます
⇒部下2名のOJTや教育+CRAとして試験を実施していただきます
・外部就労の場合は、製薬メーカーでの勤務となりキャリアアップを目指すCRAには最適の環境をご提供いたします
・CRA経験が浅い方は、受託型CROでの外部就労から経験を積んでいただくことも可能です
・派遣期間中も定期面談・継続研修等を通じ手厚くサポートいたします
・同社は東証一部上場企業のクオールホールディングスの事業会社です
■外部就労型:サブPL
・症例登録促進のための治験実施施設に対する症例プッシュ訪問
・外注先のCRO及びCRAメンバーのマネジメント、コントロール
・SOPに規定されているCRO−CRAに対するSponsor Oversight Visit
・承認申請を想定しPMDA査察に向けたGCP必須文書の品質管理
・PLのプレゼン資料や週報、各会議の議事録、各種資料の作成
■受託型:臨床研究モニター(CRA)■休日:週休二日制
- 求める経験
-
...
・CROでの医薬品臨床開発試験/臨床開発CRA経験者
※1試験以上の試験完遂の実務 または 選定から終了まで一連の開発プロセス経験
ご経験値に応じて、最適なキャリアをご提案いたします。■職種未経験者:不可
- 想定年収
- 450万円 - 800万円
- 語学力
-
英語力:初級以上
(Senior) Clinical Research Associate
- 採用企業名
- 外資製薬企業
- 職種
-
メディカル・バイオ - 臨床開発モニター
- 雇用形態
- 無期雇用
- 勤務地
-
東京都
- 仕事内容
-
...
Essential Functions of the job:
Conducts monitoring (pre-study, initiation, routine monitoring, and closeout visit), if require
Conducts co-monitoring visits, if required
Assists with investigator/site identification
Assists site to prepare Institutional Review Board/Ethics Committee (IRB/EC) submissions
Facilitates clinical trial site contract and budget negotiation
Manages site queries and communications
Assists in managing clinical trials, if required
Establishes regular lines of communication with sites and CSMs
Provides protocol and related study training to assigned sites
Evaluates the quality and integrity of site practices – escalating quality issues as appropriate
Manage the progress of assigned studies by tracking regulatory submissions and approvals, recruitment and enrollment, case report form (CRF) completion and submission, and data query generation and resolution.
Performs QC of Trial Master Files; creates, maintains, and closes out TMFs; is key in set up, conduct, and close out of ancillary services for studies
Independently deliver clinical start-up component of assigned sites with accountability for time, cost and quality for assigned activities, which include, but not limited to,
Investigator/Site identification, including conduct feasibility activity to identify investigators and conduct site visit to confirm qualification for the required study.
Prepare, review, submit and QC submissions to Institution Review Board (IRB) to obtain clinical trial authorizations and approvals
Prepare, review, and approve site level critical documents for IP release.
Develop and finalize Country and Site-Specific ICFs.
Perform site contract/ budget negotiation during start-up and maintenance phase. (If required)
Review and finalize subject compensation rule and insurance as per local regulations.
Review and translate subject recruitment materials as per local regulations if required.
Assist CSMs in managing clinical trial during startup phase.
Assist in maintain and update company-level investigator database.
Establish, maintain and enhance relationship with key opinion investigators and sites.
Proactively identify potential issues and seek improvement. Take initiative for issue resolution. Coordinate the risk management process encompassing proactive risk identification, evaluation (probability and impact) and mitigation plans.
Performs QC of Trial Master Files; creates, maintains, and closes out TMFs; is key in set up, conduct, and close out of ancillary services for studies.
Perform other duties as assigned by management
Description for focusing on Japan:
Supports to build Japan organization and required process such as Local SOP and WI.
Supports rCSM to perform county activity for new studies if required.
Conducts Site Motivation visits.
Prepares and supports PMDA inspection.
Other tasks, if needed.
Supervisory Responsibilities: Not applicable
Travel: up to 40-70% time, as required■休日:完全週休二日制, 年末年始
- 求める経験
-
...
Qualification Required:
Education Required:
BS in a relevant scientific discipline and at least 3 years or more (CRA) monitoring experience in the pharmaceutical or CRO industry
Experience in oncology global trials preferred
Other Qualifications:
Understands clinical trial processes with a thorough knowledge of ICH and associated regulatory guidelines
At least 3 years or more (CRAII) monitoring experience in the Pharmaceutical or CRO industry
Excellent communication and interpersonal skills
Excellent organizational skills and ability to prioritize and multi-task
Fluent in English (writing and speaking)■職種未経験者:不可
- 想定年収
- 600万円 - 900万円
- 語学力
-
英語力:中級以上
Clinical Research Associate (CRA) / CRA Lead 【関東窓口】
- 採用企業名
- ICONクリニカルリサーチ合同会社
- 職種
-
メディカル・バイオ - 臨床開発モニター
メディカル・バイオ - 臨床開発リーダー・臨床開発プロジェクトマネージャー
- 雇用形態
- 無期雇用
- 勤務地
-
大阪府 東京都
- 仕事内容
-
...
【臨床開発モニター/モニターリーダー】
Global⼜はLocal試験におけるCRA業務
・担勠する試験の進捗状況についてOn-site⼜はOff-siteで監視し、治験実施計画、SOPs、ICH/J-GCP、
その他の適用される法規則に沿って、試験が実施、記録、報告されていることを保証する。
・医療務関との契約交渉、締結に責任を有する。
・他のクリニカルチームメンバーと緊密に連携して、発⽣した試験実施上の問題について、適時の解決を図る。
・経験の浅いメンバーに適切な指導を与え、メンバーの成⻑に貢献する。
※会社の仕組みづくり・プロセスづくりにも携わっていただけます。
※組織を牽引していく、リーダー、マネージャー候補の採用も同時に検討されています。■休日:完全週休二日制, 土, 日, 祝日
- 求める経験
-
...
【学歴:必須要件】
大学卒又は医療系(看護師、臨床検査技師等)の資格保有者
【職務経験等:必須要件】
製薬会社、CROにおける2年以上のCRA経験
業務に支障にならない英語読解力(writing and reading skill)
【職務経験等:望ましい要件】
他のCRAを指導、育成した経験■職種未経験者:不可
- 想定年収
- 500万円 - 1000万円
- 語学力
-
英語力:初級以上
【R&D】Clinical Site Lead (BioPharma), Site Management & Monitoring Group, BioPharma Clinical Operations, Development Operations
- 採用企業名
- アストラゼネカ株式会社
- 職種
-
メディカル・バイオ - 臨床開発モニター
- 雇用形態
- 無期雇用
- 勤務地
-
大阪府 東京都
- 仕事内容
-
...
【職務内容 / Job Description】
Clinical Site Lead (CSL) is a field-based role within Site Management & Monitoring (SMM) at AstraZeneca K.K., dedicated to supporting clinical trials within Japan. The CSL will be assigned to dedicated disease area and proactively drive site performance, enhance site engagement, and foster strong relationships with investigators and site staff based on enhancing knowledge at the specific disease area. The CSL will focus on driving recruitment performance and ensuring strong CRO oversight, without direct site management and monitoring responsibilities. This role will contribute to operational feasibility assessments and provide input on recruitment and retention strategies as well.
【Key Responsibilities】
•Planning: Contribute to the accurate site and recruitment plan
•Partnerships: Establish strategic partnership models and frameworks for deployment across key clinical sites and investigators.
•Communication: Maintain awareness of market activities, policies, trends, technologies, and information affecting the business, to support the ongoing improvement of clinical recruitment efforts in line with company policies
•Strategic Input: Provide SMM input to clinical study documents, including Clinical Study Protocol (CSP), Informed Consent Form (ICF), and Monitoring Plan.
•Performance Monitoring: Monitor study progress, including country start-up, site activation, and recruitment
•Risk Management: Track study performance and delivery risks, and work alongside LST and GST to develop and implement mitigation plans.
•When the CSL is assigned to induvial clinical study, having full responsibility for the site and study management from AZ KK, the CSL will take following responsibilities.
•Lead and manage all activities related to site management and monitoring including the following with agreed timelines and company standard quality in Japan.
•Plan and deliver a site selection strategy
•Plan patient recruitment strategy including SMO managements and following patient recruitment progress
•Lead and manage CRAs including CRO CRAs to deliver clinical study data
•Develop and manage risk mitigation plans and contingency plans to execute site managements and monitoring from site qualification to site close on time.
•Lead and manage the quality of clinical study data.
•Lead and manage queries and quality issues related to site management and monitoring together with CRAs.
•Contribute to regulatory inspection in the area of site management and monitoring from study set up through conduct and inspection readiness.
•Escalate issues related to site management and monitoring to an appropriate person and contribute to resolve.
•Lead certain number of CRAs (incl. CRO CRAs) to in terms of information management and communication related to site management in study team to keep monitoring quality.
•Contribute to the development of Development Operations Japan by joining some projects or initiatives, e.g. Process Ownership responsibilities, CRA training.
•Contribute or encourage to innovate clinical trial environment with new technologies which AZ will implement, cooperating with study sites and sites’ staff.■休日:完全週休二日制, 年末年始
- 求める経験
-
...
■ 経験 / Experience
<必須 / Mandatory>
•At least 3-years’ experience in pharmaceutical industries or clinical research organization, preferably in Clinical Operations (CRA, Senior CRA)
•Demonstrated leadership capability in a team environment successfully.
•Negotiated some complicated issues and/or requirements with site staff.
•Team oriented and flexible; ability to respond quickly to shifting demands and opportunities.
<歓迎 / Nice to have>
•Preferred experience to collaborate with external partners.
•Performed monitoring activities from qualification visit to closure visit as a CRA.
■Education
<必須 / Mandatory>
•Bachelor’s degree in a related discipline, preferably in life science, or equivalent qualification
■能力 / Skills and capabilities
<必須 / Mandatory>
•Personal Effectiveness & Drives Accountability in Others
•Learning Agility
•Financial, Technology & Process Competency
•Communication & Teamwork – Influencing, Collaboration, Business Partnering
•Effective, risk-based thinking – Strategic thinking, Problem Solving, Critical Thinking, Decision Making
•Deliver Priorities Results & Impact – Project Management, Recruitment/Retention Planning & Action
•Act with Integrity & high ethical standards■職種未経験者:不可
- 想定年収
- 600万円 - 940万円
- 語学力
-
英語力:中級以上
【R&D】Senior Clinical Research Associate (SCRA), Development Operations, Site Management & Monitoring Department
- 採用企業名
- アストラゼネカ株式会社
- 職種
-
メディカル・バイオ - 臨床開発モニター
- 雇用形態
- 無期雇用
- 勤務地
-
大阪府 東京都
- 仕事内容
-
...
【職務内容 / Job Description】
Monitor is responsible to ensure that the trial is conducted and documented properly by carrying out the following activities when relevant and necessary to the trial and the trial site in order to verify that:
The rights and well-being of human subjects are protected.
The reported trial data are accurate, complete, and verifiable from source documents.
The conduct of the trial is in compliance with the currently approved protocol/amendment(s), with GCP, and with applicable regulatory requirement(s).
【Key Responsibilities】
• Acting as the main line of communication between the sponsor and the investigator.
• Communicate with Japan Study Leader and third party vendors as needed.
• Conduct site selection activities for verifying adequate qualifications.
• Manage and monitor the responsible sites and ensure their quality appropriately, agreed cost spent and on a timely basis by conducting the followings;
Manage the contracts of clinical trial with the responsible site and ensure the compliance with regulations and company-wide governance controls such as Ethical Interactions policy or company-legal standard.
Input appropriate information in order to create clinical trial related documents (ex. CSP, IND).
Ensure a steady implementation of supplying clinical site with study materials.
Provide investigators and site staff with education and training regarding study specific procedures including EDC system.
Manage the patient recruitment status and request acceleration of patient recruitment for Investigators and site staff.
Conduct source data verification and ensure data quality to collect appropriate clinical study data.
If necessary, support sites to ensure sites understand and resolve data queries in a timely manner.
Ensure that essential documents and source data are appropriately stored in a clinical site.
Produce monitoring activity reports appropriately and in a timely manner.
Confirm and ensure status of GCP/ICH guidelines, CSP and AZ policy compliance.
Report critical and/or serious issues relating to site management to the study team and line manager in a timely manner.
• Ensure input the latest site related information in IMPACT at appropriate timing.
• Participate in-house and/or external clinical trial related meeting (ex. Study team meeting, CRA’s meeting, Investigators’ meeting) including the preparations.
• Cooperate with site audit in liaison with QA and a site inspection by regulatory authority.
• Cooperate with resolving the result of SAE reconciliation.
• Ensure inspection ready TMF regarding site related documents.
In addition to above, Senior CRA also is to
• Lead a certain number of CRAs (incl. CRO CRAs) to in terms of information management and communication related to site management in study team to keep monitoring quality.
• Taking some tasks delegated by Study Leaders if agreed.
• Contribute to the development of Clinical Operations Japan by joining some projects or initiatives, e.g. Process Ownership responsibilities, CRA training.
• Mentor CRAs on monitoring and internal procedures.■休日:完全週休二日制, 年末年始
- 求める経験
-
...
【経験 / Experience】
<必須 Mandatory : Required only for Senior role>
• At least 3 years of CRA experience.
• Demonstrated leadership capability in a team environment successfully.
• Negotiated some complicated issues and/or requirements with site staff.
• Team oriented and flexible; ability to respond quickly to shifting demands and opportunities
(Cumulativeでなく、随時担当しているような経験)
・症例数 30前後
・施設数 4以上
・投薬例数 20以上
<歓迎 Nice to have: Preferred only for Senior role>
• Preferred experience to collaborate with external partners.
• Performed monitoring activities from qualification visit to closure visit as a CRA.
・症例数:30前後
・施設数:4以上
・投薬例数:20以上
【Education】
<必須 Mandatory>
• Bachelor’s degree (or equivalent), preferably in biological science or discipline associated with clinical research
【能力 / Skills and capabilities】
<必須 Mandatory: Required for CRA>
• Communication skill
• Negotiation skill
• Spirit of inquiry
• Ability to manage for delivering the clinical study data.
• Ability to plan effective monitoring activity
• Ability to build and manage effective relationship with Investigators and site staff
• Consistently exhibits Leadership capability as below:
Drives Accountability - focuses on delivery/results; holds self accountable: Stretches and challenges self to meet or exceed high standards of behaviour and outcomes in line with AZ Values.
Works Collaboratively - seeks diverse views: shares and seeks out diverse views, incorporating them where appropriate in order to develop better proposals and creative solutions for the business
<必須 Mandatory: Required for Senior role>
• Demonstrate superior site monitoring and management skills at the site level covering more sites with multiple protocols compared to CRAs.
• Examine issue signals and resolve them with appropriate resolution and timing.
• Effective problem and conflict resolution skills especially for CRA/Site related issues. Collaborate with other function's experts, if needed.
• Ability to share best practice and lessons learnt actively to improve quality and productivity of the wider monitoring team.
• Excellent written and verbal communication skills as well as proven negotiation, collaboration and interpersonal leadership skills
• Influencing-recognize the positive impact of own words, actions and personal presentation on others (ex. Study team, Other study teams, Clinical Operation). And also, be able to present/explain an appropriate behavior to influence others.
• The ability to build and manage effective relationship with CRO to keep monitoring quality.
• Consistently exhibits Leadership capability as below
Drives Accountability - focuses on delivery/results; holds others accountable: communicated clear expectations of behavior and outcomes as well as why these standards matter. Holds others to account for delivering them
Works Collaboratively - encourages diverse views/thinking; creates environment in which diverse viewpoints are sought and encouraged, both within beyond the team including with external partners.
Strategic Leadership – clarifies complexity: thinks more broadly than their role (e.g. externally) and uses this insight to challenge and adapt current approaches in one’s area in an effort to simplify complexity and/or ensure alignment
Acts Decisively – Takes Calculated Risk: Makes effective decisions despite uncertainty and/or incomplete information to drive business outcomes. Communicates learly to ensure alignment and empowers others with decision-making authority as appropriate.■職種未経験者:不可
- 想定年収
- 600万円 - 940万円
- 語学力
-
英語力:中級以上
Clinical Trial Manager
- 採用企業名
- バイオベンチャー
- 職種
-
メディカル・バイオ - 臨床開発モニター
メディカル・バイオ - 臨床開発リーダー・臨床開発プロジェクトマネージャー
- 雇用形態
- 無期雇用
- 勤務地
-
東京都
- 仕事内容
-
...
【所属部署の業務分掌】
・臨床試験の計画、実施(国内試験、グローバル試験)
・規制当局(PMDA, FDA 等)との相談の準備、実施
・CTD(臨床パート)の作成
・承認申請後の当局対応(規制当局との面談、照会事項回答作成 等)
・機構の適合性調査の準備、対応
【本ポジションに期待する役割】
本承認取得に向けた製造販売後臨床試験プロジェクトに参画し、下記のような役割を担っていただきます。
① 臨床試験計画に基づき、合意されたタイムライン、予算内、品質での臨床試験実施
② 機構相談実施、臨床試験実施、製造販売承認申請、GCP実地調査/適合性書面調査対応、照会事項回答等のための資料作成
また、海外展開を行うために、治験実施計画のFDA承認取得プロジェクトに参画いただきます。
【職務内容詳細】
① 臨床試験の実施に際し、CRO、 ベンダー、試験実施施設を監督し、リスクを特定して運用上の問題を解決することで、試験の進捗をモニタリングする。
② 合意されたスケジュール、予算、および社内標準の品質で、試験実施施設の管理とモニタリングに関する全てのアクティビティを主導し管理する。
③ 施設選定/被験者募集戦略の立案及び実施する。
④ 問題をタイムリーに解決することにより、臨床試験データの質を確保する。
⑤ CROが試験実施施設の管理を実行するためのリスク軽減プランとコンティンジェンシープランの作成と管理を行う。
⑥ 信頼性保証部門と協力して、外部/内部監査に関連する活動をリードし、割り当てられたプロジェクトに関して規制当局の査察対応に貢献する。
⑦ すべての試験関連文書が最終保管されていること、そしてTMFが完成していることを保証する。
⑧ 試験実施計画書、同意説明文書作成への関与、日本語と英語間の翻訳を保証する。
⑨ 試験の管理に関する課題のエスカレーションを行なうとともに、課題解決に貢献する。
⑩ CROや中央検査機関等のビジネスパートナーとのコミュニケーションや交渉を行い、社内クロスファンクショナルチームやKOLとの調整を行う。
⑪ 臨床開発計画立案及び機構相談資料、試験総括報告書、CTD、照会事項回答作成に関与する。
⑫ 臨床開発業務関連SOPや様式の作成及びメンテナンスを行う。
⑬ その他、臨床開発部長のサポートを行う。■休日:完全週休二日制, 夏季休暇, 年末年始
- 求める経験
-
...
Senior Clinical Trial Managerの要件となります。
※年数・PJ数は目安となります。
【求める経験】
・Project Lead/Project Managementの経験 5年以上
・CRAの経験かつClinical Trial Manager (CTM)の経験 5年以上
・製薬会社の臨床開発部門での業務経験 5年以上
・製薬会社におけるCROのマネジメント経験 2試験以上
・PMDAのGCP実地調査/書面適合性調査の実務担当者としての経験 2プロジェクト以上
・機構相談資料、治験総括報告書、CTD作成の経験 1プロジェクト以上■職種未経験者:不可
- 想定年収
- 850万円 - 1500万円
- 語学力
-
英語力:中級以上求めるスキル:TOEIC 800点以上(ビジネス英会話レベル)
【Real-World Evidence Services疫学研究・市販後試験部門】CPM (Clinical Project Manager)
- 採用企業名
- IQVIAサービシーズ ジャパン合同会社
- 職種
-
メディカル・バイオ - 臨床開発モニター
メディカル・バイオ - 医療機器モニター
メディカル・バイオ - 臨床開発リーダー・臨床開発プロジェクトマネージャー
- 雇用形態
- 無期雇用
- 勤務地
-
東京都
- 仕事内容
-
...
【業務内容】
倫理指針または臨床研究法下で実施される臨床研究のプロジェクトマネジメント・プロジェクト体制全体を構築・管理
・試験に関わる各種プランの立案(リスクマネジメントプランなど)
・試験タイムライン・マイルストンに対する責任者
・文書全体管理、予算・請求管理
・各ファンクションの統括
・ベンダーとのコミュニケーション
・クライアントとの主な連絡窓口
■Real-World Evidence Servicesについて
医療経済・アウトカム研究(HEOR)、疫学、医薬品の安全性、リアルワールド・エビデンス(RWE)などに特化したスペシャリストが、世界各国の拠点で活動するIQVIA。プロトコルから統計解析、パブリケーションまでリアルワールド・エビデンス創出を包括的にサポートし、科学的根拠に基づく意義あるインサイトを提供します。当該ポジションは、その一手を担うポジションとなります。(GPSPに準拠した製造販売後データベース調査も対応)
【会社紹介・ビジョン】
私たちIQVIAは、ヒューマンデータサイエンスの先駆的な企業として、医療・ヘルスケアの前進に取り組む皆様をIQVIAならではの革新的なソリューションによってご支援することで、「誰もが、より健康に自分らしく生きられる社会」の実現を目指しています。世界最大規模を誇る医療・ヘルスケア関連データを基盤に、人・データ・サイエンスを融合させた見地から、未だ満たされない治療ニーズに応える、新たな医薬品や医療機器の開発と市販化、厳格化する規制やコンプライアンスへの対応、持続可能な医療システム推進の支援など、患者さんをはじめとするすべての人々のために、より良い未来へと医療・ヘルスケアを前進させていく力となることが、私たちの使命です。
世界100以上の国と地域で約9万人が活動するIQVIAの日本法人として、IQVIAジャパンでは約6,000人が一丸となり、この使命に向かって日々、力を尽くしています。
- 求める経験
-
...
<必須要件>
クリニカルまたはリアルワールド部門での
・Project Manager経験(試験立案から論文作成までの流れを熟知)
・進捗管理及び関連部署との調整をした経験
・イノベイティブ、提案力のある人
・交渉力
・専門の疾患領域を持っている人
・英語力(読み書きは必須。スピーキングは出来れば尚可)■職種未経験者:不可
- 想定年収
- 900万円 - 1100万円
- 語学力
-
英語力:初級以上
東京本社:臨床開発(治験運営担当)
- 採用企業名
- 富士製薬工業株式会社
- 職種
-
メディカル・バイオ - 臨床開発モニター
その他 - その他
- 雇用形態
- 無期雇用
- 勤務地
-
東京都
- 仕事内容
-
...
当社臨床開発部門にて、治験全体の運営管理やモニタリング業務の管理・サポートを担当いただくポジションです。
外勤や時間外対応が難しい方でも、医薬品開発経験(例:モニター経験)を活かして活躍いただけます。
■主な業務内容
1.治験運営管理
┕スタディーチームミーティング運営
┕リスクマネジメント試験担当者
┕セントラルモニタリング試験担当者
┕治験薬管理担当者(RTSM/IWRSの担当も含む)
┕モニタリング報告書レビュー(症例、スタッフ)
2.オペレーション及びモニタリング業務の管理・サポート
┕契約書関係(リーガルチェック・稟議・捺印)
┕ドキュメント作成
┕進捗管理
┕SSU・CTA対応
3.GCP共通項目や臨床開発部の運営
┕SOP新設・改定時の対応
┕CAPA管理事務局
※上記すべての業務をお任せするわけではなく、経験・スキルに応じてご担当いただく業務を検討いたします。
■中長期的ビジョン
女性医療貢献度No.1を目指し、産婦人科領域では継続して新薬開発とジェネリック品上市を継続してゆきます。もう一つの柱として提携先のアイスランド・アルボテック社から導入するバイオシミラーについては複数品目の国内販売を予定しており、現在その開発が進行中です。
※10年後のあるべき姿を描いた当社の「2035年ビジョン」を当社HPよりご覧いただけます。
https://www.fujipharma.jp/
■当社の強み
領域に特化したメーカーは少なく、医師からの信頼を築きやすいです。また、産婦人科領域は現在、厚生労働省による不妊治療助成金の増額が決まったことや、緊急避妊薬が今後薬局でも取り扱われるようになるなど非常に注目が集まっている領域であり、その中でも当社は日本を代表する産婦人科領域のリーディングカンパニーとしての地位を確立しています。
■キャリアディベロップメント(ジョブローテション)制度
当社では、キャリアディベロップメント(ジョブローテーション)制度が存在し、原則1年に一度、自身のキャリア希望を申請することが可能です。そのため、当社では自身のキャリアパスを自由に挑戦することが可能です。■休日:完全週休二日制, 土, 日, 祝日, 夏季休暇, 年末年始
- 求める経験
-
...
■必須要件
製薬会社またはCROで医薬品開発担当として従事した経験が3年以上あり、かつ以下①~③のいずれかの業務経験がある方
①QMS
②DM(データマネジメント)
③CRA(モニタリング業務)
■歓迎スキル・経験
・GCP、医薬品開発に関連する法令、規制、及びガイドラインに関する高度な知識をお持ちの方
・書面及び口頭でのコミュニケーションを含む優れた対人関係能力
・科学・医学関係の知識を吸収・利用する能力
・複数の業務が並行する中で優先順位を判断し適切に実行できる能力及び目標に対する強いコミット
■求める人物像
・責任感があり、いずれは独力で活躍できそうな方もしくはそのようなイメージで活躍したいと考えられる方
・手順を重んじながらも、重要なポイントを押さえた上で柔軟な考えができる方■職種未経験者:不可
- 想定年収
- 500万円 - 800万円
- 語学力
-
英語力:不問
Site Management Associate (SMA) / 内勤モニター
- 採用企業名
- PSI CRO Japan株式会社
- 職種
-
メディカル・バイオ - 臨床開発モニター
- 雇用形態
- 無期雇用
- 勤務地
-
大阪府 東京都
- 仕事内容
-
...
Join our international team and be the key support to clinical research projects, streamlining communication, maintaining systems and managing documents & information.
The scope of responsibilities will include:
・Maintenance of databases and tracking systems
・Serves as the primary sites’ contact point for vendors, study supplies, and access management
・Work with large amount of documents, including their compiling, procurement, processing and filing
・Communication with company departments and external parties
・Communication point for investigative sites participating in the clinical research projects
・Coordination of site-specific query resolution, project training and access to vendor-related systems for site teams
・Ensures proper administration of sites and vendors payments
・Receiving and routing all mails and incoming calls
・Assistance with meeting arrangements
・Preparation of draft agendas and minutes of project meetings■休日:完全週休二日制, 土, 日, 祝日, 年末年始
- 求める経験
-
...
・College/University Degree (Life Sciences)
・Prior administrative experience in Clinical Research / CRO environment, preferably in an international setting
・Good organizational and planning skills, problem-solving abilities, flexibility
・Detail-oriented, able to multi-task and work effectively in a fast-paced environment
・Team-oriented with excellent customer service and interpersonal skills, including a positive attitude to tasks and projects
・Fluent English and Japanese■職種未経験者:不可
- 想定年収
- 400万円 - 600万円
- 語学力
-
英語力:中級以上
Study Startup Specialist
- 採用企業名
- PSI CRO Japan株式会社
- 職種
-
メディカル・バイオ - 臨床開発モニター
- 雇用形態
- 無期雇用
- 勤務地
-
大阪府 東京都
- 仕事内容
-
...
Take your career to the next level and lead challenging study activation process on a country/regional level. You will support clinical research teams and ensure PSI projects start smoothly and on time.
You will:
Maintains study-specific and corporate startup tracking systems
Facilitates site budgets and contract negotiations
Supports site regulatory document collection
Under supervision, may prepare initial submission dossiers to competent authorities, ethics committees, and/or site submission dossiers (as applicable)
Communicates with the project team and investigational sites throughout the study startup phase
Develops site specific startup timelines and enrollment projections and is responsible for meeting the site activation milestones
May review study specific translations
Supervises Trial Master File (TMF) maintenance throughout the study startup phase■休日:完全週休二日制, 土, 日, 祝日, 年末年始
- 求める経験
-
...
College/University degree in Life Sciences or an equivalent combination of education, training and experience
2-3 years prior clinical study and site startup experience
Well-developed communication and organizational skills
Ability to negotiate and build relationships at all levels
Leadership, mentoring, and organizational skills
English and Japanese skills (High Business level to Fluent)■職種未経験者:不可
- 想定年収
- 500万円 - 800万円
- 語学力
-
英語力:中級以上
Clinical Research Associate / 臨床開発モニター
- 採用企業名
- PSI CRO Japan株式会社
- 職種
-
メディカル・バイオ - 臨床開発モニター
- 雇用形態
- 無期雇用
- 勤務地
-
大阪府 東京都
- 仕事内容
-
...
As a CRA, you will work on the frontline of communication with project stakeholders, ensuring timelines, targets. You will have the opportunity to work on clinical studies in various therapeutic areas and indications while maintaining the highest quality standards in the industry. This function operates at site and country level and can be assigned to projects as monitor or lead monitor.
Join the PSI team and help drive innovation and excellence in advancing healthcare solutions.
You will:
Prepare, conduct and reports site selection, initiation, routine monitoring and close-out visits
Perform CRF review, source document verification and query resolution
Be responsible for site communication and management
Act as a communication point between project teams and the site
Leads project team calls on a country level
Ensure that subject recruitment targets are timely defined, communicated, recorded and met, and project timelines are followed at site level
Participate in feasibility research
Support regulatory team in preparing documents for study submissions
Prepare and participate in site audits and inspections
CRAとして、モニタリングおよび施設マネジメントの様々な業務を遂行し、正確で規制要件に従ったデータを確保し、被験者の権利と安全を確保します。さまざまな治療領域および適応症の臨床試験に取り組む機会があり、業界最高レベルの品質基準を維持します。PSI チームに参加し、ヘルスケアソリューションの革新と卓越性を推進してください。
▪ 施設選定、契約手続き、モニタリング、終了手続き、及び報告書の作成
▪ CRF レビュー、SDV、およびクエリ解決
▪ 施設とのコミュニケーションおよび管理の責任
▪ プロジェクトチームと施設間のコミュニケーション窓口
▪ 施設ごとの目標症例数の協議・記録、および目標達成の確保、およびプロジェクトタイムラインの遵守
▪ フィジビリティリ調査の遂行
▪ 臨床試験関連書類の準備における薬事チームのサポート
▪ 施設監査・当局査察の準備および参加■休日:完全週休二日制, 土, 日, 祝日, 年末年始
- 求める経験
-
...
College/University degree in Life Sciences, Pharmacy, RN or an equivalent combination of education, training & experience
At least 3 years’ site monitoring experience at a CRA II or equivalent qualification level in Japan
Experience in all types of monitoring visits in Phase II and/or III
Experience in feasibility assessment and study set-up process is preferable
Therapeutic area experience in Oncology /Hematology /Gastroenterology (IBD) /Infectious Diseases /Neurology/Renal is a plus
Full working proficiency in Japanese and Intermediate English
PC skills to be able to work with MS Word, Excel and PowerPoint
Ability to plan, multitask and work in a dynamic team environment
Communication, collaboration, and problem-solving skills
Ability to travel up to 30% to 40%
【必須要件】
▪ 生命科学の学位、または同等の教育、訓練、経験
▪ 日本において少なくとも2 年間の独立した施設モニタリング経験
▪ Phase II またはIII の一連のモニタリング業務の経験
▪ MS Office アプリケーションの使用習熟
▪ 計画、マルチタスク、およびダイナミックなチーム環境での業務遂行能力
▪ コミュニケーション、コラボレーション、および問題解決スキル
▪ 日本語ですべての業務遂行能力を行えるレベルの高い日本語スキルおよび中級程度の英語スキル
【歓迎要件】
▪ 腫瘍学/血液学/消化器病学(IBD)/感染症/神経学/腎臓の治療領域の経験■職種未経験者:不可
- 想定年収
- 600万円 - 1000万円
- 語学力
-
英語力:中級以上
マネージャー候補 / 臨床開発職/東京都千代田区(日比谷)
- 採用企業名
- 旭化成ファーマ株式会社
- 職種
-
メディカル・バイオ - 臨床開発モニター
メディカル・バイオ - 臨床開発リーダー・臨床開発プロジェクトマネージャー
- 雇用形態
- 無期雇用
- 勤務地
-
東京都
- 仕事内容
-
...
医薬品の臨床開発職のリーダー業務をお任せいたします。今回の募集では、臨床開発オペレーションのリーダーまたはサブリーダーを即戦力として担える人財を募集します。前職までのご経験と入社時のプロジェクトの状況に応じ、入社時の業務およびポジションを決定します。今までのご経験を活かし、国内治験および国際共同治験まで幅広くご活躍いただくことができます。
臨床開発オペレーションのリーダーとして、以下の業務を担当していただきます。(担当PJの進捗状況に応じて業務内容が変わります。)サブリーダーの場合はこれらのサポートをしていただきます。
(1)実行に必要な組織体制を構築する(社内チーム、専門医師、CRO等外部委託を含む)
(2)中期予算の策定、年度予算/実算の管理
(3)臨床PJリーダーと共に臨床開発プランの検討をする
(4)臨床開発オペレーション業務を統括する
1)治験薬概要書、治験実施計画書、ICFを作成する
2)モニタリング戦略の立案及び実行(CROオーバーサイトを含む)
3)ベンダー(中央検査会社、症例登録センター等)管理をする
4)当局による適合性調査の対応をする
<従事すべき業務の変更の範囲>
会社が定める業務
<仕事の魅力・やりがい>
医薬品開発の最前線で活躍することができます。また、若手が多い組織ですので、後輩・部下の育成を継続的に行うことで、自身が培った経験を組織に浸透させることができます。
<キャリアパスイメージ>
▼1〜3年後
前職までのご経験と入社時のプロジェクトの状況に応じてキャリアパスを本人と上司とで形成していきます。臨床開発オペレーションのリーダーとして入社した場合にはPOC試験、大規模臨床試験、海外試験、国際共同試験のオペレーションリーダーとなっていただくことを期待しています。
▼3〜5年後
前職までのご経験と入社時のプロジェクトの状況に応じてキャリアパスを本人と上司とで形成していきます。ご本人の意向と適性に応じて、臨床開発オペレーションのリーダーとしての専門性をさらに高めていただく、または臨床プロジェクトリーダーとして活躍していただくことも検討します。
<取扱い商材>
ART-123,AK1830,AK1910 他
<参考URL>
https://www.asahikasei-pharma.co.jp/rd/pipeline.html
- 求める経験
-
...
<必要な業務経験/スキル>
以下の全てを満たす方
・臨床開発オペレーションのリーダー経験、または、サブリーダー経験(臨床開発モニターを含む実務経験6年以上)
・海外試験または国際共同治験の実行経験
・臨床試験に関わるベンダーマネジメント経験(症例登録センター、中央検査会社、等)
<必要資格>
英語での会議に参加してコミュニケーションがとれる英語力、および、その実務経験
<望ましい業務経験/スキル>
モニタリングCROのマネジメントの経験、臨床試験計画の立案経験
<望ましい資格>
英語:TOEIC 700
<求める人物像>
・社内関連部署とコミュニケーションを取り業務理解を深め、課題を発見し解決に導く思考力を持った方。
・主体性を持って、チームを率いてプロジェクトを推進していける方。
・社内外問わず、協調しながら業務を進めリーダーとしてチームをまとめられる方。
・主体的に常に新しいことを学び続けることができる方。
・新しい業務にも果敢に挑戦する意欲のある方。
・困難な状況に直面しても前向きさを失わず、周囲を鼓舞して推進できる方。■職種未経験者:不可
- 想定年収
- 500万円 - 1000万円
- 語学力
-
英語力:中級以上TOEIC:700点以上英語でのメール返信、英語資料の読解が出来るレベル
臨床開発モニター(CRA)~CTM(CROコントロール)
- 採用企業名
- 株式会社アクセライズ
- 職種
-
メディカル・バイオ - 臨床開発モニター
- 雇用形態
- 無期雇用
- 勤務地
-
大阪府 東京都
- 仕事内容
-
...
派遣先メーカーの名刺を持ち、メーカーの一員となってCRA業務全般を行います。
メーカー側での業務を経験することで、CRAとしての経験値や知見が一気に上がります。
【具体的には…】
・業務開始準備、医療機関及び治験責任医師候補の選定
・IRB申請手続き、治験契約手続き
・治験契約締結後の施設セットアップ、医療関係者トレーニングの実施
・症例登録促進活動、試験の進捗状況の管理
・原資料等の直接閲覧、症例報告書のSDV
・安全性情報の収集・報告
・他部署(DM、安全性、薬事等)とのコミュニケーション など
派遣先によって、複数領域の試験を同時に担当できたり、プロトコールの作成段階から携われたり、試験のマネジメントに関われたり、タスクチームの一員になったりと、貴重な経験を積むことができます。
最近の派遣案件の傾向は、グローバル試験が多く、領域はオンコロジー、プライマリー、指定難病など幅広く、年単位で進めていくものがほとんどです。
入社後は、希望を伺った上で派遣先を決定します。■休日:完全週休二日制, 年末年始
- 求める経験
-
...
【必須となる条件】
■CRA経験者(新GCP、企業主導治験、主担当として2年以上)
【歓迎(WANT)】
・オンコロジー試験経験者
・グローバル試験経験者(英語力を伸ばしたい、活かしたいという方)
【求める人物像】
■同社を通してステップアップを図りたい方
(外資系メーカーへのキャリアパス等)
■がんや抗がん剤など専門的な治験を通し、短期間でのレベルアップを図りたい方
■英語力を身につけたい方
■製薬メーカーの正社員スタッフと肩を並べ、最前線で活躍し、最新の知識を得たい方■職種未経験者:不可
- 想定年収
- 550万円 - 900万円
- 語学力
-
英語力:不問*英語力は必要ありませんが、入社してから英語を学習する機会が増えます。
- 1
- 2
- 3
- 4
WEBではお伝えできない情報を、
戦略的な観点からお伝えします
JACでは、気になる企業の 同業他社との比較により、その企業や求人の採用傾向など 特長をより明確に知ることができます。
| 求人の観点 | A社 | B社 | CD社・・ |
|---|---|---|---|
| 採用される方の属性 | XXXX | XXXX | |
| 採用される/されない方の違い | XXXX | XXXX | |
| 実年収の高低 | XXXX | XXXX | |
| 企業の戦略・成長性 | XXXX | XXXX |
JACでは、約1,000名ものコンサルタントが直接企業とコンタクトをとり、 求人のスペックだけではなく、社風や部・課・チームの雰囲気など気になる情報もお伝えしております。
| 求人の観点 | A社 | B社 | CD社・・ |
|---|---|---|---|
| 年収傾向 | XXXX | XXXX | |
| 社内・部内の雰囲気 | XXXX | XXXX | |
| 上司の傾向 | XXXX | XXXX | |
| 本社・支社の関係性 | XXXX | XXXX |
JACは複数のコンサルタントが
あなたをスカウト
複数のコンサルタントがサポートするJACのコンサルティング
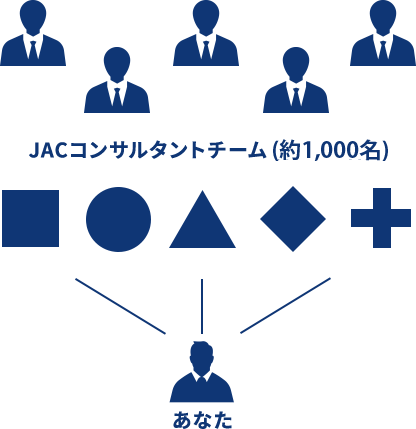
各職種のプロが多角的に
求人を紹介するので、
幅広い選択肢からお選び頂けます。
特定のコンサルタントが担当する一般的な外資系エージェント
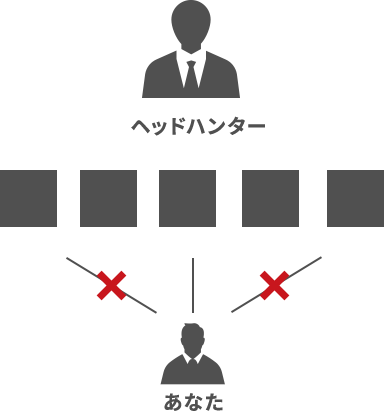
一人のヘッドハンターが選んだ
求人だけなので
偏りや漏れが出ることがあります。
あなたのスキルを活かせる求人&あなたと近しいスキルの方の
「転職成功の傾向」





