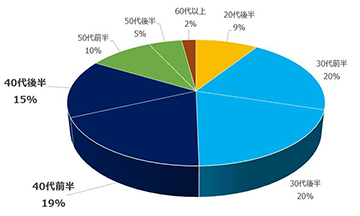
特集
業界別転職情報
職種別転職情報
国内エリア別転職情報
海外エリア別転職情報
転職サポート サービスの流れ
-
Step 1ご登録

まずはご登録ください。弊社コンサルタントから、ご連絡いたします。
-
Step 2面談・求人紹介

業界・職種に特化したコンサルタントが、複数人であなたをサポート。
最適な求人・キャリアプランをご提案いたします。 -
Step 3応募・面接

ご提案求人の中から、ご興味いただいた企業へ、あなたをご推薦します。
レジュメ添削、面接対策、スケジュール調整は、コンサルタントにお任せください。
-
Step 4内定・入社

条件交渉や入社日の調整などをお手伝いいたします。
ご要望によって、円満退社に向けたアドバイス等も行っております。 -
Step 5アフターフォロー

ご入社後も、キャリアについてご相談がございましたら、お気軽にご連絡ください。
人生を共に歩むパートナーとして、あなたのキャリアをサポートし続けます。